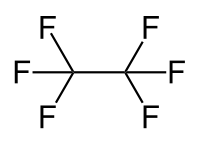
Hexafluorethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hexafluorethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2F6 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 138,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
6,25 kg·m−3 (unter Normalbedingungen)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−78,2 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (7,78 mg·l−1 bei 25 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
12340 (bezogen auf 100 Jahre)[3] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1344,2 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hexafluorethan ist eine chemische Verbindung aus der Gruppe der Fluorkohlenwasserstoffe und ist als aliphatisches gesättigtes Fluorkohlenwasserstoff ein Perfluorcarbon.
Darstellung und Gewinnung[Bearbeiten | Quelltext bearbeiten]
Eine Synthesevariante ist die Umsetzung von Trifluoressigsäure mit Xenondifluorid. Hier werden zunächst die instabilen Ester (CF3COO)2Xe und (CF3COO)XeF gebildet, deren Zersetzung bzw. Decarboxylierung zu Trifluormethylradikalen und dann zum Hexafluorethan führt.[5]
Eine unerwünschte Quelle von Hexafluorethan sowie Tetrafluormethan ist die Produktion von Aluminium mittels Schmelzflusselektrolyse aus Kryolith. Hierbei entstehen die Fluorkohlenstoffe aus dem Fluor des Kryoliths und dem Kohlenstoff der Elektroden.[6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
In Druckgasflaschen liegt Hexafluorethan als verdichtetes Gas vor. Unter 19,7 °C unter Druck ist es ein verflüssigt vorliegendes Gas. Beim Ausströmen der Flüssigkeit oder beim Entweichen großer Gasmengen bilden sich kalte Nebel, die sich am Boden ausbreiten. Oberhalb von 800 °C zersetzt sich die Verbindung, wobei unter Luft Fluorwasserstoff, Kohlenstoffmonoxid und Kohlenstoffdioxid entstehen. Der kritische Punkt liegt bei 19,89 °C, 30,39 bar und 0,601 kg·l−1; der Tripelpunkt bei −100,10 °C und 0,26490 bar.[7]
Mit 12340 (bezogen auf 100 Jahre) hat Hexafluorethan ein sehr hohes Treibhauspotential, da das Gas lange in der Atmosphäre verbleibt.[8] Das Ozonabbaupotential liegt bei 0.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Hexafluorethan wird in der Halbleiter-Industrie als Ätzgas und beim Plasmaätzen sowie zum Reinigen von CVD-Kammern eingesetzt.[9] Es dient weiterhin als Treibgas, gasförmiger Isolierstoff (in aufgeschäumten Stoffen) und als Kältemittel.[10] Große Mengen Hexafluorethan werden bei der Aluminiumerzeugung freigesetzt. In der Medizin wird es eingesetzt, um bei Glaskörperabhebung und Netzhautablösung den Glaskörper zu ersetzen.[11] Das Gas wird danach von Körper resorbiert und durch Flüssigkeit ersetzt.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Hexafluorethan ist schwerer als Luft und in hohen Konzentrationen erstickend.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu Hexafluorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- ↑ Yalkowsky SH, Dannenfelser RM; The AQUASOL dATAbASE of Aqueous Solubility. Ver 5. Tucson, AZ: Univ AZ, College of Pharmacy (1992).
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- ↑ e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Xenon(II)-fluorid, abgerufen am 20. Januar 2018.
- ↑ https://www.sciencedirect.com/science/article/pii/1352231095004998
- ↑ Helmut Schan: Handbuch der reinsten Gase. Springer, 2005, ISBN 978-3-540-23215-5, S. 307.
- ↑ Mark Mantel: Microsoft: KI lässt Emissionen um bis zu 40 Prozent steigen. In: Heise Online. 17. Mai 2024, abgerufen am 21. Mai 2024.
- ↑ Hexafluorethan (airliquide)
- ↑ R116 (Linde-Gas)
- ↑ Kathrin Kässmann: Die pharmakologische Vitreolyse mittels Ocriplasmin beim vitreomakulären Traktionssyndrom: SD-OCT-morphologische Veränderungen und klinischer Verlauf. (PDF; 1,3MB) Dissertation an der Ludwig-Maximilians-Universität München, 2019.
