Leuckart-Wallach-Reaktion
Die Leuckart-Wallach-Reaktion ist eine Namensreaktion der organischen Chemie und nach den deutschen Chemikern Rudolf Leuckart und Otto Wallach benannt. Sie beschreibt die reduktive Aminierung von Ketonen oder Aldehyden mit Ameisensäure.[1][2][3][4] Bei der Verwendung von Formaldehyd als Alkylierungsreagenz zur Bildung methylierter Amine nennt man diese Reaktion auch Eschweiler-Clarke-Reaktion.
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Bei der Leuckart-Wallach-Reaktion können unter einfachen Bedingungen Amine (besonders tertiäre) hergestellt werden. Hierbei setzt man einen Aldehyd oder ein Keton mit Ammoniak oder einem primären bzw. sekundären Amin und Ameisensäure um.[5]

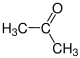
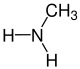
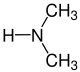
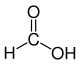
Die Reste R1 bis R4 in der obigen Reaktion können entweder Wasserstoff-Atome, Methylgruppen oder auch Arylgruppen (z. B. eine Phenylgruppe) oder andere längerkettige, ggf. verzweigte Alkylgruppen sein. In der folgenden Galerie sind die Strukturformeln der einfachsten, möglichen Edukte und Ameisensäure gezeigt:
-
Ameisensäure
Statt Ammoniak und Ameisensäure kann auch Ammoniumformiat verwendet werden, das im Laufe der Reaktion beim Erwärmen in Ammoniak und Ameisensäure dissoziiert. Es kommt zur Bildung eines resonanzstabilisierten Carbenium-Immonium-Ions (wie zum Beispiel auch bei der Mannich-Reaktion). Damit die Reaktion überhaupt abläuft muss das Reaktionsgemisch auf 160–185 °C erhitzt werden.[6][7]
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Ein möglicher Reaktionsmechanismus wird im Folgenden aufgezeigt.[7][6] Der Übersichtlichkeit halber wird auch hier Acetaldehyd mit einem primären Amin (NH2CH3) umgesetzt.

Zunächst wird das Methylamin (2) an den Acetaldehyd (1) nucleophil addiert. Nach einer Kondensation entsteht ein Carbeniumion 3 mit zwei mesomeren Grenzformeln. Daraufhin wird mit Hilfe der Ameisensäure ein cyclischer Übergangszustand 4 gebildet. In zwei Schritten wird dieser dann zunächst decarboxyliert, dann deprotoniert, um das sekundäre Amin 5 zu bilden.
Anwendung
[Bearbeiten | Quelltext bearbeiten]Diese Reaktion wird vorwiegend zur Synthese von tertiären Aminen verwendet. Außerdem können Amine mit reduktionsempfindlichen Gruppen alkyliert werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Rudolf Leuckart: Ueber eine neue Bildungsweise von Tribenzylamin. In: Berichte der Deutschen Chemischen Gesellschaft. Band 18, Nr. 2, 1885, S. 2341–2344, doi:10.1002/cber.188501802113.
- ↑ Peter La Roche deBenneville, Jane Horrocks Macartney: The Behavior of Aliphatic Aldehydes in the Leuckart–Wallach Reaction. In: Journal of the American Chemical Society. Band 72, Nr. 7, 1950, S. 3073–3075, doi:10.1021/ja01163a074.
- ↑ Otto Wallach: Zur Kenntniss der Terpene und der ätherischen Oele. Zweiundzwanzigste Abhandlung. In: Justus Liebigs Annalen der Chemie. Band 272, Nr. 1, 1893, S. 99–122, doi:10.1002/jlac.18932720103.
- ↑ Maurice Lee Moore: The Leuckart Reaction. In: Roger Adams et al. (Hrsg.): Organic Reactions. Band 5. John Wiley & Sons, New York 1949, ISBN 978-0-471-26418-7, Kapitel 7, S. 301–330, doi:10.1002/0471264180.or005.07 (4. Druck, 1960 [PDF] Übersichtsartikel).
- ↑ Eintrag zu Leuckart-Reaktionen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Februar 2014.
- ↑ a b T. Laue, A. Plagens,: Namens- und Schlagwortreaktionen der organischen Chemie. Teubner Verlag, Wiesbaden 2006, ISBN 978-3-8351-0091-6, S. 215–216.
- ↑ a b c W. Uhl, A. Kyriatsoulis: Namens- und Schlagwortreaktionen in der organischen Chemie. Friedr. Vieweg & Sohn, Braunschweig 1984, ISBN 3-528-03581-1, S. 102–104.