Pentafluorphenylammoniumtriflat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pentafluorphenylammoniumtriflat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H3F8NO3S | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis blaßrotes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 333,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Pentafluorphenylammoniumtriflat ist das Salz aus Pentafluoranilin und Trifluormethansulfonsäure, das als saurer und metallfreier Katalysator für die Bildung von Carbonsäureestern, -thioestern und Lactonen, sowie für Umesterungen unter vergleichsweise milden Bedingungen mit hoher Effizienz eingesetzt werden kann.[3] Auch bei der Ritter-Reaktion von Nitrilen zu Amiden werden mit PFPAT unter moderaten Bedingungen hohe Ausbeuten erzielt.[5]
Darstellung[Bearbeiten | Quelltext bearbeiten]
Pentafluorphenylammoniumtriflat wird bei Zugabe stöchiometrischer Mengen von Trifluormethansulfonsäure TfOH zu 2,3,4,5,6-Pentafluoranilin (aus Hexafluorbenzol und Natriumamid in flüssigem Ammoniak[6] bzw. mit Ammoniak in Ethanol im Bombenrohr[7]) in 95%iger Ausbeute erhalten.[3]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Pentafluorphenylammoniumtriflat ist in Reinsubstanz ein weißes, wasserlösliches Kristallpulver.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Die einfach zugängliche starke Brønsted-Säure Pentafluorphenylammoniumtriflat soll nach Literaturangaben als „grüner Katalysator“ eine Reihe von Vorteilen für sauer katalysierte Reaktionen besitzen.[3][5] Erwähnt werden günstiger Preis, niedrige Toxizität, geringe Einsatzmengen, milde Reaktionsbedingungen, einfache Durchführung, z. B. lösungsmittelfreie Eintopfprozesse, kurze Reaktionszeiten, Luft- und Wasserbeständigkeit, hohe Ausbeuten, schonend gegenüber N-haltigen Substraten und vielen funktionellen Gruppen, einfache Aufarbeitung und gute Recyclierbarkeit.
Mit katalytischen Mengen (1–10 mol%) von Pentafluorphenylammoniumtriflat können in Toluol als Lösungsmittel bei erhöhten Temperaturen (40–110 °C) Carbonsäureester, Thioester und makrocyclische Lactone gebildet und Umesterungen katalysiert werden.[3]

Dabei werden meist Ausbeuten über 90 % erzielt.
Aus 16-Hydroxypalmitinsäure wird unter Verdünnungsbedingungen (10 mmolar in Toluol) das siebzehngliedrige Lacton 16-Hexadecanolid in 87%iger Ausbeute, neben 10 % des ringförmigen Diesters, gebildet.

Auch ohne Lösungsmittel verläuft die Acylierung von Alkoholen, Phenolen und Aminen mit Acetanhydrid unter PFPAT-Katalyse (10 mol%) meist bei Raumtemperatur und innerhalb < 60 Minuten in Ausbeuten über 90 %.[8]

So erfolgt die Bildung von 2-Phenylethylacetat aus 2-Phenylethanol und Acetanhydrid bei Raumtemperatur innerhalb von 20 Minuten in 97%iger Ausbeute.
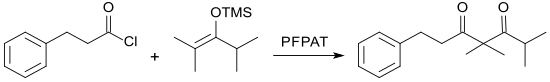
Pentafluorphenylammoniumtriflat katalysiert die C-Acylierung von Enolsilylethern mit Carbonsäurechloriden zu β-Diketonen in guten bis sehr guten Ausbeuten (62–92 %).[9]
Mit PFPAT kann auch die Synthese von α-Aminophosphonaten aus Aldehyden, Aminen und Dimethylphosphit analog einer Standardsynthese des Totalherbizids Glyphosat mit Ausbeuten von 80–95 % katalysiert werden.[10]

Statt Schwefelsäure (oder einem H2SO4/Essigsäure-Gemisch) kann Pentafluorphenylammoniumtriflat als wirksamer Katalysator in der Ritter-Reaktion eingesetzt werden.[5]
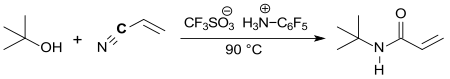
Zusatz katalytischer Mengen von PFPAT zu einem Gemisch von tert-Butanol oder tert-Butylacetat und Acrylnitril liefert in 92%iger Ausbeute N-tert-Butylacrylamid.
Die Katalyse der Polykondensation von Milchsäure mit lediglich 0,1 mol% PFPAT in aromatischen Lösungsmitteln liefert Polymilchsäure mit mittleren Molmassen bis zu > 100,000 g/mol.[2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Eintrag zu Pentafluoranilinium trifluoromethanesulfonate bei TCI Europe, abgerufen am 28. Mai 2019.
- ↑ a b Patent EP2028209A1: Organic acid catalyst for polylactic acid synthesis. Angemeldet am 12. Juni 2007, veröffentlicht am 25. Februar 2009, Anmelder: National University Corp., Kyoto Institute of Technology, Erfinder: A. Abiko, H. Iwahashi.
- ↑ a b c d e T. Funatomi, K. Wakasugi, T. Misaki, Y. Tanabe: Pentafluorophenylammonium triflate (PFPAT): an efficient, practical, and cost-effective catalyst for esterification, thioesterification, transesterification, and macrolactone formation. In: Green Chem. Band 8, Nr. 12, 2006, S. 1022–1027, doi:10.1039/B609181B.
- ↑ a b MSDS Synquest Laboratories. 12. Januar 2017, abgerufen am 26. Juni 2019 (englisch).
- ↑ a b c S. Khaksar, E. Fattahi, E. Fattahi: Organocatalytic synthesis of amides from nitriles via the Ritter reaction. In: Tetrahedron Lett. Band 52, Nr. 45, 2011, S. 5943–5946, doi:10.1016/j.tetlet.2011.08.121.
- ↑ E.J. Forbes, R.D. Richardson, J.C. Tatlow: Pentafluoroaniline. In: Chemistry & Industry. 1958, S. 630.
- ↑ G.M. Brooke, J. Burdon, M. Stacey, J.C. Tatlow: 350. Aromatic perfluoro compounds. Part IV. The reaction of aromatic polyfluoro compounds with nitrogen-containing bases. In: J. Chem. Soc. 1960, S. 1768–1771, doi:10.1039/jr9600001768.
- ↑ S. Khaksar, H. Zakeri: Pentafluorophenylammonium triflate as a mild and new organocatalyst for acylation of alcohols, phenols, and amines under solvent-free condition. In: Comb. Chem. High Throughput Screen. Band 15, Nr. 7, 2012, S. 576–579, doi:10.2174/138620712801619203.
- ↑ A. Iida, J. Osada, R. Nagase, T. Misaki, Y. Tanabe: Mild and efficient pentafluorophenylammonium triflate (PFPAT)-catalyzed C-acylations of enol silyl ethers or ketene silyl (thio)acetals with acid chlorides. In: Org. Lett. Band 9, Nr. 10, 2007, S. 1859–1862, doi:10.1021/ol070191b.
- ↑ F. Malamiri, S. Khaksar: Pentafluorophenylammonium triflate (PFPAT): A new organocatalyst for the one-pot three-component synthesis of α-aminophosphonates. In: J. Chem. Sci. Band 126, Nr. 3, 2014, S. 807–811, doi:10.1007/s12039-014-0636-6.

