Propinal
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propinal | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H2O | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis braune Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 54,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Ethanol, Diethylether, Benzol, Toluol, Aceton[4], in Chloroform und Methanol[1] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Propinal ist eine organische Verbindung mit der Summenformel C3H2O. Es ist die einfachste chemische Verbindung eines Aldehyds mit einer C≡C-Dreifachbindung und gehört zur Stoffklasse der Alkinale.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Das Vorkommen von Propinal neben den C3H2O-Isomeren Cyclopropenon und Propadienon H2C=C=C=O wurde in Molekülwolken im interstellaren Raum nachgewiesen.[7]
Die chemische Synthese von Propargylaldehyd wurde erstmals 1898 von Ludwig Claisen berichtet.[3] Ausgehend von 2,3-Dibrompropionaldehyd-diethylacetal (aus Acrolein durch Brom-Addition und Acetalisierung mit Orthoameisensäuretriethylester) wird durch zweifache Dehydrobromierung (Abspaltung von Bromwasserstoff HBr) Propinal-diethylacetal gebildet, das mit Schwefelsäure zum freien Propinal gespalten wird.[8]

Eine Laborvorschrift aus Organic Syntheses beschreibt die Herstellung von Propinal durch Oxidation von Propargylalkohol mit giftigem, mutagenem und karzinogenem Chrom(VI)-oxid und Schwefelsäure in bescheidener Ausbeute von 35 bis 41 %.[6] In einer verbesserten Variante mit Methylethylketon MEK als Lösungsmittel für Propinol und Zugabe einer wässrigen Lösung von Chromtrioxid/Schwefelsäure bei Raumtemperatur wird eine Ausbeute von 91 % erzielt.[2] Wegen der problematischen Eigenschaften von Chromtrioxid und der schwierigen Aufarbeitung und Entsorgung von Cr(VI)-Salzen ist diese Syntheseroute nicht mehr zeitgemäß.
Auch für größere Ansätze geeignet erscheint die Vakuum-Pyrolyse des einfach zugänglichen Dipropargylethers (in einer Williamson-Ethersynthese aus Propinol und Propargylbromid zugänglich)[9] bei 750 °C zu Propinal (80 % Ausbeute) und Propadien.[10]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Propinal ist als Reinsubstanz eine farblose Flüssigkeit, die sich in Wasser und vielen organischen Lösungsmitteln löst. Bei längerem Stehen verfärbt sich die Verbindung von gelb nach braunrot.[11] Nach L. Claisen ist „der Propargylaldehyd ein Liquidum, welches Nase und Augen ebenso heftig oder noch stärker reizt als Acrolein“.[3] Spuren von Peroxiden oder Basen können eine explosionsartige Polymerisation von in Glasbehältern gelagertem Propargylaldehyd initiieren.[12] Daher sollte Propinal mit Vorsicht in maximal 10 %iger Lösung in höhersiedenden Lösungsmitteln, z. B. Toluol, gehandhabt und in Lagerbehältern aus Aluminium oder Kunststoff aufbewahrt werden.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Additionen an die Dreifachbindung
[Bearbeiten | Quelltext bearbeiten]Bei der Addition von Dimethylamin an die Dreifachbindung von Propargylaldehyd im Sinne einer Vinylierung nach Reppe entsteht 3-Dimethylaminoacrolein in 88%iger Ausbeute als gelbes Öl.[13]
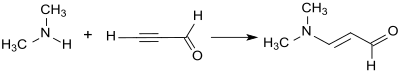
In ähnlicher Weise addieren Nukleophile mit Hydroxygruppen oder Thiolgruppen an Propinal unter Bildung von in 3-Stellung substituierten Acroleinen, die eine Doppelbindung in Konjugation mit einer Carbonylgruppe im Molekül aufweisen.
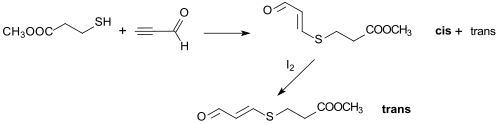
So erzeugt die Michael-Addition von 3-Mercaptopropionsäuremethylester an Propinal ein cis/trans-Isomerengemisch eines 3-thiosubstituierten Acroleins, da durch Behandlung mit Iod in vollständig in das stabilere trans-Isomere überführt werden kann.[14]
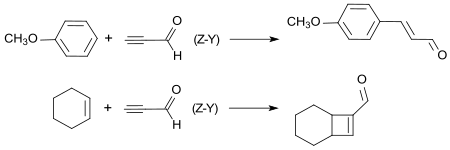
In einer [1,4]-Addition reagiert Propinal, das durch Einschluss in Zeolith-Y-Käfigstrukturen sowohl stabilisiert als auch aktiviert wird, mit wenig reaktiven Methoxybenzolen, wie z. B. Anisol zu dem Aromastoff 4-Methoxyzimtaldehyd oder in einer [2+2]-Cycloaddition mit unreaktiven Cycloalkenen, wie z. B. Cyclohexen zu dem bicyclischen ungesättigten Aldehyd Bicyclo[4.2.0]oct-7-en.[15]
Additionen an die Carbonylgruppe
[Bearbeiten | Quelltext bearbeiten]Grignard-Verbindungen addieren leicht an die Carbonylgruppe des Propargylaldehyds, wobei die entsprechenden sekundären Alkohole gebildet werden.[4]

Cycloadditionen mit Propinal
[Bearbeiten | Quelltext bearbeiten]Die 1,3-Dipolare Cycloaddition von Aziden, z. B. Trimethylsilylazid (CH3)3SiN3 an Propargylaldehyd liefert 4-Formyl-1,2,3-triazol in brauchbarer Ausbeute.[16]

1,2-Diaminobenzole kondensieren beim Erhitzen in einem Methanol/Dimethylformamid-Gemisch unter Cyclisierung zu Tetraaza[14]annulenen, die Schwermetallionen, wie z. B. Mangan3+, Nickel2+ oder Kupfer2+, komplexieren und als Modellverbindungen für Porphyrine dienen können.[17]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Propynal. Abgerufen am 28. Oktober 2019.
- ↑ a b M.G. Veliev, M.M. Guseinov: An improved synthesis of propynal. In: Synthesis. Band 6, 1980, S. 461, doi:10.1055/s-1980-29052.
- ↑ a b c L. Claisen: Propargylaldehyd und Phenylpropargylaldehyd. In: Ber. Dtsch. Chem. Ges. Band 31, Nr. 1, 1898, S. 1021–1023, doi:10.1002/cber.189803101185.
- ↑ a b c Patrick Perlmutter: Propargyl Aldehyde. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rp262m.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 24.
- ↑ a b J.C. Sauer: Propiolaldehyde In: Organic Syntheses. 36, 1956, S. 66, doi:10.15227/orgsyn.036.0066; Coll. Vol. 4, 1963, S. 813 (PDF).
- ↑ J.-C. Louisen et al.: The interstellar chemistry of H2C3O isomers. In: Monthly Notices of the Astronomical Society. Band 456, Nr. 4, 2016, S. 4101–4110, doi:10.1093/mnras/stv2866 (arxiv.org [PDF]).
- ↑ V.K. Ahluwalia, R. Aggarwal: Organic Syntheses: Special Techniques. Alpha Science International Ltd., Pangbourne, UK 2001, ISBN 1-84265-058-0, S. 27–28.
- ↑ R.E. Geiger, M. Lalonde, H. Stoller, K. Schleich: Kobalt-katalysierte Cycloadditionen von Alkinen und Nitrilen zu Pyridinen: Ein neuer Zugang zu Pyridoxin (Vitamin B6). In: Helv. Chim. Acta. Band 67, Nr. 5, 1984, S. 1274–1282, doi:10.1002/hlca.19840670513.
- ↑ H. McNab, G. Morel, E. Stevenson: A short, convenient synthesis of propynal. In: J. Chem. Res. (S). Band 6, 1997, S. 207, doi:10.1039/A700453B.
- ↑ F. Wille, L. Saffer, W. Weißkopf: Zur Kenntnis des Propargylaldehyds I: Darstellung, Polymerisation und Reaktion mit Aminen. In: Justus Liebigs Ann. Chem. Band 568, Nr. 1, 1950, S. 34–46, doi:10.1002/jlac.19505680103.
- ↑ D. Makula, P. Lamy: Sécurité: Stabilité de l’aldehyde propargylique (propynal). In: L’actualité chimique. Juin-Juillet, Nr. 103, 1983, S. 31–34 (www.lactualitechimique.org/numero/103).
- ↑ Patent DE944852: Verfahren zur Herstellung von Derivaten des 3-Amino-acroleins. Angemeldet am 25. August 1955, veröffentlicht am 28. Juni 1956, Anmelder: Badische Anilin- & Soda-Fabrik AG, Erfinder: F. Wille.
- ↑ R. Hanko, M.D. Hammond, R. Fruchtmann, J. Pfitzner, G.A. Place: Design, synthesis, and 5-lipoxygenase-inhibiting properties of 1-thiosubstituted butadienes. In: J. Med. Chem. Band 33, Nr. 4, 1990, S. 1163–1170, doi:10.1021/jm00166a013.
- ↑ D. Hayashi, Y. Igura, Y. Masui, M. Onaka: Stabilization and activation of unstable propynal in the zeolite nanospace and its application to addition reactions. In: Catal. Sci. Technol. Band 19, Nr. 7, 2017, S. 4422–4440, doi:10.1039/C7CY01161J.
- ↑ M.M. Demina, P.S. Novopashin, G.I. Sarapulova, L.I. Larina, A.S. Smolin, V.S. Fundamenskii, A.A. Kashev, A.S. Medvedeva: 1,3-Dipolar cycloadditions of trimethylsilyl azide to propynals and dimerization of 1H-1,2,3-triazole-5-carbaldehydes to tricyclic bis-hemiaminals. In: Russian J. Org. Chem. Band 40, Nr. 12, 2004, S. 1804–1809, doi:10.1007/s11178-005-0103-4.
- ↑ K. Sakata, H. Nakamura, M. Hashimoto: Preparation and characterization of isothiocyanatomanganese(III) complexes of tetraaza[14]annulenes. In: Inorg. Chim. Acta. Band 83, Nr. 3, 1984, S. L67–L70, doi:10.1016/S0020-1693(00)82375-0.

