Antimon(III)-acetat
Zur Navigation springen
Zur Suche springen
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
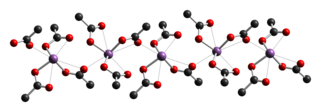
| ||||||||||||||||
| _ Sb3+ _ C _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Antimon(III)-acetat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | C6H9O6Sb | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 298,89 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
1,22 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Antimon(III)-acetat ist eine chemische Verbindung des Antimons aus der Gruppe der Acetate mit der Konstitutionsformel Sb(CH3COO)3.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Antimon(III)-acetat kann durch Reaktion von Antimon(III)-oxid mit Essigsäureanhydrid oder Antimon(III)-Salzen mit Essigsäure gewonnen werden.[1][4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Antimon(III)-acetat ist ein farbloser Feststoff.[3] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21 (Raumgruppen-Nr. 4).[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Antimon(III)-acetat wird als Katalysator bei der Herstellung von synthetischen Fasern verwendet.[3][6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Jane E. Macintyre: Dictionary of Inorganic Compounds, Supplement 4. CRC Press, 1996, ISBN 978-0-412-75020-5, S. 27 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g Datenblatt Antimony(III) acetate, 99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 11. Februar 2019 (PDF).
- ↑ a b c Datenblatt Antimony(III) acetate, 97% bei Alfa Aesar, abgerufen am 11. Februar 2019 (Seite nicht mehr abrufbar).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 37 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michael Hall, D. Bryan Sowerby: An timony(III) acetate and thioacetate: spectra and crystal structures. In: Journal of the Chemical Society, Dalton Transactions. 1980, S. 1292, doi:10.1039/DT9800001292.
- ↑ M. D. Lechner, Klaus Gehrke, Eckhard H. Nordmeier: Makromolekulare Chemie Ein Lehrbuch für Chemiker, Physiker, Materialwissenschaftler und Verfahrenstechniker. Springer-Verlag, 2014, ISBN 978-3-642-41769-6, S. 164 (eingeschränkte Vorschau in der Google-Buchsuche).

