Chloraceton
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
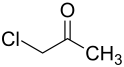
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Chloraceton | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H5ClO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, tränenreizende Flüssigkeit von stechendem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 92,52 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,15 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
119 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser (100 g·l−1)[2], Ethanol und Diethylether[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Chloraceton ist eine klare, augenreizende Flüssigkeit. Ihre Herstellung ist relativ einfach aus Aceton und Chlor möglich.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Im Ersten Weltkrieg kam Chloraceton als Augenreizstoff zur Anwendung, zuerst im November 1914 durch Frankreich unter dem Decknamen „Tonite“. Später wurde es durch die Franzosen unter dem Decknamen „Martonite“, einem Gemisch aus Brom- und Chloraceton, als augenreizender Kampfstoff eingesetzt.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die technische Herstellung geschieht durch Chlorierung von Aceton, beispielsweise durch Einleiten von Chlorgas in eine Suspension von Calciumcarbonat in Aceton. Besonders bei zu heftiger Chlorierung entstehen als Nebenprodukte auch andere Chloracetonverbindungen, wie beispielsweise 1,3-Dichloraceton, 1,1,1-Trichloraceton und 1,1,3-Trichloraceton. Diese sind um einiges toxischer, aber weniger reizend als (Mono-)Chloraceton und müssten durch Destillation abgetrennt werden. Dies gelingt wegen der nahe beieinander liegenden Siedepunkte jedoch nicht einfach.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]In Chemielaboratorien kann es zu ungewollter Freisetzung von Chloraceton kommen, wenn bei Chlorierungen Aceton als Lösungsmittel eingesetzt wird oder wenn Aceton zur Reinigung von Apparaturen, die mit Chlorierungsmittel oder Chlor (in gelöster Form) verunreinigt sind, verwendet wird. Bei Kontakt kommt es zu erheblichen Reizerscheinungen bis hin zu schweren Verätzungen der Augen, auch die Haut und die Atemwege werden angegriffen. Bei der Herstellung von Acetonperoxid mit Salzsäure als Katalysator kann Chloraceton entstehen, wenn das Reaktionsgemisch zu heiß wird.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Chloraceton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ a b c d e f g h i Eintrag zu Chloraceton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Januar 2020. (JavaScript erforderlich)


