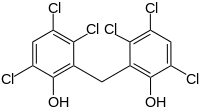
Hexachlorophen
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Hexachlorophen | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H6Cl6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
hellbrauner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 406,91 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Hexachlorophen ist ein chloriertes Bisphenol und damit ein Chlorkohlenwasserstoff, der als Desinfektionsmittel Verwendung findet.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Hexachlorophen wird durch Kondensation von 2,4,5-Trichlorphenol mit Formaldehyd in Gegenwart von konzentrierter Schwefelsäure hergestellt.[3]
Wirkung
[Bearbeiten | Quelltext bearbeiten]Hexachlorophen wirkt stark bakterizid gegen gram-positive Bakterien. Das Wachstum von Staphylococcus aureus auf Agar wird durch Hexachlorophen noch in einer Verdünnung von 1:8.000.000 verhindert. Hexachlorophen wirkt in höheren Konzentrationen haut-, augen- und schleimhautreizend, neurotoxisch und embryotoxisch. Bei Versuchstieren wurden Schädigungen der weißen Gehirnsubstanz und am Rückenmark festgestellt. In großen Mengen oral eingenommen, führt Hexachlorophen zu Appetitlosigkeit, Durchfall, und Lähmungen.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hexachlorophen wird als Desinfektionsmittel, Arzneimittel (zur Trichophyten- und Trematodenbehandlung, gegen Akne und Hämorrhoiden sowie in der Viehwirtschaft) und als Pflanzenschutzmittel verwendet. Es dient weiterhin als Mikrobiozid in Kosmetika (seit 1985 in der Bundesrepublik Deutschland verboten), Wasch- und Reinigungsmitteln und als Zusatz zu Textilien und Kunststoffen. Dazu kommen Anwendungen bei Recyclingprozessen (Papier, WC-Papier, …).[6]
Zulassung
[Bearbeiten | Quelltext bearbeiten]Seit 1. Januar 1990 dürfen hexachlorophenhaltige Arzneimittel in Österreich nicht mehr in Verkehr gebracht werden. In Deutschland ist der Einsatz in Kosmetika seit 1985 verboten.[7] In den Staaten der EU und in der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[8]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Monitoring der Desinfektionsmittel Triclosan, Triclocarban und Hexachlorophen in Fließgewässern, Sedimenten, Klärschlämmen, Zu- und Abläufen von Kläranlagen der Landesanstalt für Umwelt, Messungen und Naturschutz Baden-Württemberg
- Nachweis und Bestimmung von Hexachlorophen in der österreichischen Kosmetik – Analysenverordnung
- Herstellung von Hexachlorophen
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Hexachlorophene bei Sigma-Aldrich, abgerufen am 7. November 2016 (PDF).
- ↑ a b c Eintrag zu 2,2'-Methylenbis(3,4,6-trichlorphenol) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Hexachlorophen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Eintrag zu Hexachlorophene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Hexachlorophene in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021. (Seite nicht mehr abrufbar)
- ↑ Umweltbundesamt: Fact Sheet Triclosan, Triclocarban, Hexachlorophen ( vom 12. November 2011 im Internet Archive) (PDF; 35 kB).
- ↑ Rechtsinformationssystem des österreichischen Bundeskanzleramtes, abgerufen am 12. Oktober 2013.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Hexachlorophene in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 26. März 2016.

