Iodstickstoff
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
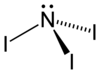
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Iodstickstoff | ||||||||||||
| Andere Namen |
Stickstofftriiodid | ||||||||||||
| Summenformel | NI3 | ||||||||||||
| Kurzbeschreibung |
schwarzbrauner Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 394,7 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Löslichkeit |
in Wasser Zersetzung[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Iodstickstoff (NI3), auch als Stickstofftriiodid oder chemisch korrekt mit Iodnitrid bezeichnet, ist eine äußerst labile chemische Verbindung von Iod und Stickstoff, die bereits bei geringster Energiezufuhr durch Wärme, Reibung, Schlag, Erschütterung oder sogar Alphastrahlung eine stark exotherme Reaktion (Explosion) zeigt.
Stickstofftriiodid gehört zur Stoffgruppe der Stickstoffhalogenide.
Synthese
[Bearbeiten | Quelltext bearbeiten]In reiner Form wurde Iodstickstoff erstmals 1990 aus Bornitrid und Iodfluorid bei −30 °C in Trichlorfluormethan synthetisiert.[3]
Eher gebräuchlich ist die Darstellung durch Einleiten von Ioddampf oder Zugabe von Iodkristallen in eine konzentrierte wässrige Ammoniaklösung. Der Stickstoff wird (nur formal-analog zu den Kohlenwasserstoffen) halogeniert. Dies führt zur Bildung eines meist als Iodstickstoff bezeichneten polymeren Stickstofftriiodid-Ammoniak-Adduktes, NI3·NH3. Dieses bildet schwarzbraune, rhombische Kristalle, die sich in Wasser zu Iodwasserstoff, Iod und Ammoniak zersetzen.
Das Produkt ist hochexplosiv und muss mit der nötigen Vorsicht behandelt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trockener Iodstickstoff zersetzt sich bei geringster mechanischer Einwirkung explosionsartig. Selbst die leichte Berührung mit einer Vogelfeder löst die Explosion aus. Auch spontane Explosionen kommen vor. Die Explosion erfolgt stets mit sehr scharfem Knall. Beim trockenen Feststoff ist größte Vorsicht geboten. Im Gegensatz zum getrockneten Feststoff kann man mit alkoholfeuchtem Iodstickstoff gefahrlos arbeiten.
Ammoniak-Addukte
[Bearbeiten | Quelltext bearbeiten]Je nach Temperatur und Lösungsmittel bildet Iodstickstoff mit Ammoniak den Hydraten entsprechende, verschieden gefärbte, polymere Addukte:[4]
- bei Temperaturen von −30 bis −15 °C fällt durch Zugabe von Iod in eine konzentrierte Ammoniaklösung ein schwarz-brauner Niederschlag der Zusammensetzung (NI3 · NH3)n aus;
- bei −35 bis −70 °C entsteht in flüssigem Ammoniak ein grünes, irisierendes, schlechtlösliches Polymer der Formel (NI3 · 3 NH3)n;
- bei −75 bis −95 °C bildet sich in einem 2:1-Gemisch aus Chloroform und Ammoniak ein roter Niederschlag eines Polymeren (NI3 · 5 NH3)n.
Die beiden letzteren Addukte können ineinander durch Variation der Temperatur umgewandelt werden. Alle Polymere bestehen aus Ketten von NI4-Tetraedern, die zusätzlich von Ammoniakmolekülen umgeben sind.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Aufgrund seiner Instabilität findet Iodstickstoff als Sprengstoff keine praktische Anwendung. Die Synthese von Kleinstmengen ist zwar zur didaktischen Veranschaulichung im Rahmen des Chemieunterrichts interessant, allerdings in Deutschlands Schulen explizit verboten.[5] Die getrocknete Verbindung ist sehr empfindlich und zerfällt bei Berührung oder Erwärmung sofort mit einem spektakulären Knall, der von einer violetten Iod-Wolke begleitet wird. Einzigartig ist die Eigenschaft von NI3, dass seine Explosion sogar von Alphastrahlung ausgelöst werden kann. Zwar sind photochemisch ausgelöste Explosionen bei anderen Stoffen bekannt (welche dann auch von Gammastrahlung induziert werden kann), jedoch ist eine derartige Reaktion auf Bestrahlung mit Alphateilchen (=4He-Kerne) nur von diesem Stoff bekannt.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Synthesevorschrift (PDF-Datei; 35 kB)
- Video mit einem Detonationsversuch
- Video
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Iodstickstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H.P. Latscha, H.A. Klein: Anorganische Chemie, 2002, S. 312ff, Springer, ISBN 3-540-42938-7
- ↑ J. Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compound (PDF; 465 kB), Pure Appl. Chem., Vol. 49, pp. 67–73, Pergamon, 1977
- ↑ Richtlinie zur Sicherheit im Unterricht, Beschluss der KMK vom 9. September 1994 i. d. F. vom 14. Juni 2019, S. 85, abgerufen am 10. Mai 2020.


