Magnesiumarsenat
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ Mg _ As _ O | ||||||||||
| Kristallsystem |
tetragonal | |||||||||
| Raumgruppe |
I42d (Nr. 122) | |||||||||
| Gitterparameter |
a = 6,783 Å, c = 18,963 Å | |||||||||
| Allgemeines | ||||||||||
| Name | Magnesiumarsenat | |||||||||
| Verhältnisformel | Mg3(AsO4)2 | |||||||||
| Kurzbeschreibung |
weißes Kristall oder Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 350,75 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Magnesiumarsenat, Mg3(AsO4)2 ist das Magnesium-Salz der Arsensäure.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Magnesiumarsenat-Octahydrat kommt natürlich auch als Mineral Hörnesit vor.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Das Octahydrat kann durch Mischen der wässrigen Lösungen von Magnesiumsulfat, Natriummonohydrogenarsenat und Natriumbikarbonat erhalten.[3]
Das Heptahydrat entsteht, wenn Natriumdihydrogenarsenat anstelle des Monohydrogensalz in der obigen Zubereitung benutzt wird. Das Decahydrat entsteht, wenn Kalium- oder Ammoniummagnesiumorthoarsenat mehrere Stunden lang mit Wasser aufgeschlossen wird. Bei der Entwässerung können Hydrate mit einem Gehalt von 6, 5, 3 und 2 erhalten werden.[3]
Das Anhydrat kann aus einer Schmelze von Magnesiumcarbonat und Arsen(V)-oxid bei 1450 °C gewonnen werden.[3]
Eigenschaften
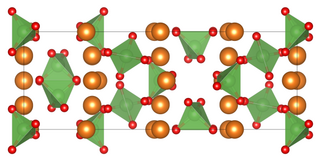
[Bearbeiten | Quelltext bearbeiten]Magnesiumarsenat ist ein weißes Kristall oder Pulver. Es ist nicht brennbar und praktisch unlöslich in Wasser. Ab 100 °C findet eine Kristallwasserabspaltung statt, welche sich mit höherer Temperatur verstärkt.[1] Die Kristallstruktur des Anhydrats ist tetragonal (a = 6,783 Å, c = 18,963 Å, Z = 6 und Raumgruppe I42d (Raumgruppen-Nr. 122). Die Struktur enthält zwei verschiedene AsO4-Gruppen mit durchschnittlichen Bindungslängen von 1,678 bzw. 1,690 Å. Zwei der drei Magnesium-Ionen sind oktaedrisch koordiniert, und das Dritte die Stelle der 4 Symmetrie einnimmt. Das wasserfreie Salz zersetzt sich bei Erwärmung über 1100 °C im Vakuum, wobei Magnesiumoxid, Arsen(III)-oxid und Sauerstoff entstehen.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Magnesiumarsenat wird als rot fluoreszierender Leuchtstoff für die Auskleidung von Reklameleuchtröhren verwendet.[4] Es wurde auch als Insektizid eingesetzt.[5]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Beim Inhalieren oder Verschlucken wirkt die Verbindung giftig. Der Stoff gilt als krebserzeugend.[1]
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]- Magnesiumpyroarsenat Mg2As2O7
- Magnesiumhydrogenarsenat MgHAsO4
- Magnesiumdihydrogenorthoarsenat Mg(H2AsO4)2
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu Magnesiumarsenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Februar 2019. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Arsenverbindungen, mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. Februar 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 299 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. Bünemann, W. Klosterkötter: Toxikologische und arbeitshygienische Prüfung eines Leuchtstoffes aus Magnesiumarsenat. In: Internationales Archiv für Gewerbepathologie und Gewerbehygiene. Band 20, Nr. 1, Januar 1963, S. 21–35, doi:10.1007/BF00370045.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Einatmen
- Krebserzeugender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Magnesiumverbindung
- Arsenat
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 19
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 75




