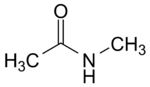
N-Methylacetamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Methylacetamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H7NO | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit schwachem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 73,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
0,94 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
206–208 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,433 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[6] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
N-Methylacetamid ist eine chemische Verbindung aus der Gruppe der Carbonsäureamide. Die Verbindung gehört zu den besonders besorgniserregenden Stoffen der Europäischen Chemikalienagentur (ECHA).
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]N-Methylacetamid kann durch Reaktion von heißer Essigsäure oder Essigsäureanhydrid mit Methylamin gewonnen werden.[7][8] Ebenfalls möglich ist die Darstellung durch Reaktion von N,N′-Dimethylharnstoff mit Essigsäure[8] oder die Reaktion von Acetonoxim mit Schwefelsäure.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]N-Methylacetamid ist ein brennbarer, schwer entzündbarer, hygroskopischer, kristalliner, farbloser Feststoff mit schwachem Geruch, der löslich in Wasser ist.[1] Es sind mehrere isomere Formen bekannt.[10][11] In Lösung liegt es zu 97–100 % als (Z)-Isomer mit polymerer Struktur vor.[12][2] Die Verbindung besitzt eine hohe Dielektrizitätskonstante von 191,3 bei 32 °C.[13]
Verwendung
[Bearbeiten | Quelltext bearbeiten]N-Methylacetamid wird als Zwischenprodukt bei der Herstellung von Agrochemikalien und als Lösungsmittel in der Elektrochemie verwendet.[3][7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k Eintrag zu N-Methylacetamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b J. F. Coetzee: Recommended Methods for Purification of Solvents and Tests for Impurities International Union of Pure and Applied Chemistry. Elsevier, 2013, ISBN 978-1-4831-3845-9, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt N-Methylacetamide, 99% bei Alfa Aesar, abgerufen am 17. April 2017 (Seite nicht mehr abrufbar).
- ↑ Datenblatt N-Methylacetamide, ≥99% bei Sigma-Aldrich, abgerufen am 17. April 2017 (PDF).
- ↑ Eintrag zu N-methylacetamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. April 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 21. April 2020.
- ↑ a b Eintrag zu N-METHYLACETAMIDE in der Hazardous Substances Data Bank (via PubChem), abgerufen am 17. April 2017.
- ↑ a b D.R. Buhler, D.J. Reed: Nitrogen and Phosphorus Solvents. Elsevier, 2013, ISBN 978-1-4832-9020-1, S. 166 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie. Walter de Gruyter GmbH & Co KG, 2015, ISBN 978-3-11-033105-9, S. 581 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Noemi G. Mirkin, Samuel Krimm: Conformers of cis-N-methylacetamide. In: Journal of Molecular Structure: THEOCHEM. 236, 1991, S. 97, doi:10.1016/0166-1280(91)87010-J.
- ↑ Ab initio vibrational analysis of hydrogen-bonded trans- and cis-N-methylacetamide. In: Journal of the American Chemical Society. Band 113, Nr. 26, 1. Dezember 1991, S. 9742–9747, doi:10.1021/ja00026a005.
- ↑ K.-H. Hellwich: Stereochemie Grundbegriffe. Springer-Verlag, 2013, ISBN 978-3-662-10051-6, S. 43 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Covington: Physical Chemistry of Organic Solvent Systems. Springer Science & Business Media, 2012, ISBN 978-1-4684-1959-7, S. 247 (eingeschränkte Vorschau in der Google-Buchsuche).
