Natriumchromat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
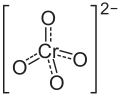
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumchromat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Na2CrO4 | ||||||||||||||||||
| Kurzbeschreibung |
geruchlose, durchscheinende gelbe Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 161,97 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
2,73 g·cm−3 (18 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
thermische Zersetzung[2] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (530 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend (CMR)[4]; zulassungspflichtig[5] | ||||||||||||||||||
| MAK |
Schweiz: 5 μg·m−3 (berechnet als Chrom)[6] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Natriumchromat ist eine chemische Verbindung der Elemente Natrium, Chrom und Sauerstoff bzw. das Natriumsalz der Chromsäure.
Gewinnung und Herstellung
[Bearbeiten | Quelltext bearbeiten]Es entsteht als Zwischenprodukt bei der Gewinnung von Chrom aus dem Mineral Chromit.[7] Das Chromiterz wird mit Natriumcarbonat und Luftsauerstoff bei 1200 °C zu Natriumchromat oxidiert.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Natriumchromat wirkt stark oxidierend.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Das Natriumsalz der Chromsäure wird im Labor als starkes Oxidationsmittel, als Markierungssubstanz in der biologischen Forschung[9], als Korrosionsschutzmittel in Kühlgeräten und als Holzschutzmittel[10] eingesetzt.
Sicherheitshinweise und gesetzliche Regelungen
[Bearbeiten | Quelltext bearbeiten]Natriumchromat kann zu Allergien führen. Der Stoff ist giftig beim Verschlucken und sehr giftig beim Einatmen. Natriumchromat wurde im Juni 2010 aufgrund seiner Einstufung als krebserzeugend (Carc. 1B), mutagen (Muta. 1B) und reproduktionstoxisch (Reprod. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[4] Im April 2013 wurde Natriumchromat danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 21. September 2017 aufgenommen.[5][11] Als Chrom(VI)-Verbindung unterliegt Natriumchromat außerdem den Beschränkungen im Anhang XVII, Nummer 47 und 72 der REACH-Verordnung (in Deutschland umgesetzt durch die Chemikalien-Verbotsverordnung).[12]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Natriumchromat bei Alfa Aesar, abgerufen am 3. Februar 2010 (Seite nicht mehr abrufbar).
- ↑ a b c d e f Eintrag zu Natriumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Sodium chromate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ a b Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Chrom(VI)-Verbindungen), abgerufen am 7. Oktober 2019.
- ↑ Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-64958-7, 3.8.3.4.1 Natriumchromat.
- ↑ Uwe Böhme: Anorganische Chemie für Dummies. WILEY-VCH, ISBN 978-3-527-70502-3, S. 198.
- ↑ I. Lauermann, H. Hecker, E. Kirchner: Erstellung von Blutvolumenreferenzwerten für erythrozytenmarkierende Indikatorverdünnungsmethoden anhand von Literaturdaten. In: Transfusion Medicine and Hemotherapy. 26, 1999, S. 360, doi:10.1159/000053520.
- ↑ PAN Pesticides Database: Sodium Chromate, abgerufen am 18. Juni 2023.
- ↑ Verordnung (EU) Nr. 348/2013
- ↑ ECHA: Liste der beschränkten Stoffe – Anhang XVII der REACH-Verordnung, abgerufen am 5. September 2020.
- Giftiger Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Giftiger Stoff bei Einatmen
- Ätzender Stoff
- Sensibilisierender Stoff
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- CMR-Stoff
- SVHC-Stoff
- Zulassungspflichtiger Stoff nach REACH-Anhang XIV
- Natriumverbindung
- Chromat
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 47
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 29
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72




