Phosphor(II)-iodid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phosphor(II)-iodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | P2I4 | |||||||||||||||
| Kurzbeschreibung |
hellrote Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 569,57 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
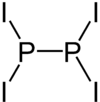
Phosphor(II)-iodid ist eine chemische Verbindung mit der Summenformel P2I4. Sie besteht aus zwei Phosphoratomen in der Oxidationsstufe +2, die über eine Einfachbindung miteinander verbunden sind. Jedes Phosphoratom besitzt des Weiteren zwei Bindungen zu Iodatomen.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Phosphor(II)-iodid kann aus den Elementen gewonnen werden. Hierzu wird weißer Phosphor mit elementarem Iod zur Reaktion gebracht.[1]
Weitere Möglichkeiten sind die Iodierung von Phosphan[1] und die Iodierung von Phosphortrichlorid mit Kaliumiodid.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Phosphor(II)-iodid ist eine bei Raumtemperatur feste Verbindung, die bei 125,5 °C schmilzt. Phosphor(II)-iodid reagiert mit Brom zu einer Mischung aus Phosphortriiodid, Phosphortribromid und den gemischten Halogeniden PBr2I und PBrI2.[4]
Die Verbindung besitzt eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2).[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Phosphor(II)-iodid kann zur Synthese von Aziridinen aus Aminoalkoholen benutzt werden.[6]
Des Weiteren wird es zur Herstellung von Nitrilen aus Carbonsäuren eingesetzt.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- ↑ a b Datenblatt Diphosphorus tetraiodide bei Sigma-Aldrich, abgerufen am 19. April 2011 (PDF).
- ↑ H. Suzuki, T. Fuchita, A. Iwasa, T. Mishina: Diphosphorus Tetraiodide as a Reagent for Converting Epoxides into Olefins, and Aldoximes into Nitriles under Mild Conditions, in: Synthesis, 1978, 12, S. 905–908; doi:10.1055/s-1978-24936.
- ↑ A. H. Cowley, S. T. Cohen: The Iodides of Phosphorus. II. The Reaction of Bromine with Diphosphorus Tetraiodide, in: Tetrahedron Letters, 1965, 4, S. 1221–1222; doi:10.1021/ic50030a029.
- ↑ Matthias F. Groh, Ulrike Müller, Ejaz Ahmed, Alexander Rothenberger, Michael Ruck: Substitution of Conventional High-temperature Syntheses of Inorganic Compounds by Near-room-temperature Syntheses in Ionic Liquids. In: Zeitschrift für Naturforschung B. 68, 2013, doi:10.5560/ZNB.2013-3141.
- ↑ H. Suzuki, H. Tani: A mild cyclization of 2-aminoalcohols to aziridines using diphosphorus tetraiodide, in: Chemistry Letters, 1984, 13, S. 2129–2130; doi:10.1246/cl.1984.2129.
- ↑ V. N. Telvekar, R. A. Rane: A novel system for the synthesis of nitriles from carboxylic acids, in: Tetrahedron Letters, 2007, 48, S. 6051–6053; doi:10.1016/j.tetlet.2007.06.108.



