Übersättigung
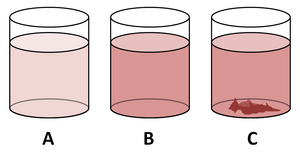
A. Ungesättigte Lösung
B. Übersättigte Lösung
C. Gesättigte Lösung mit Bodenkörper (Niederschlag)
Übersättigung ist die Bezeichnung für einen metastabilen Zustand einer Lösung oder von Dampf. Unter gewöhnlichen Bedingungen würde eine solche Überschreitung des Gleichgewichtszustands durch eine Phasenumwandlung verhindert. Bei übersättigten Systemen tritt diese jedoch nicht am erwarteten Gleichgewichtspunkt des Phasendiagramms auf. Der Temperaturbereich, in dem eine Übersättigung auftreten kann, wird auch Ostwald-Miers-Bereich (nach Wilhelm Ostwald und Henry Alexander Miers[1]) genannt.
Übersättigte Lösung
[Bearbeiten | Quelltext bearbeiten]Eine übersättigte Lösung enthält mehr von dem gelösten Stoff, als seiner Löslichkeit bei der betreffenden Temperatur entspricht.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Beim langsamen Abkühlen einer gesättigten Lösung bei ruhigem Stehen bildet sich zunächst eine übersättigte Lösung, bevor der Überschuss des gelösten Stoffes ausfällt.[2]
Ausscheidung der „zu viel“ gelösten Substanz
[Bearbeiten | Quelltext bearbeiten]Die Ausscheidung des „zu viel“ in Lösung gebliebenen Stoffes erfolgt durch
- Schütteln,
- Rühren,
- Verdunsten des Lösungsmittels,
- Reiben mit einem Glasstab an der Innenwand des Glasgefäßes, in dem die Lösung aufbewahrt wird, oder durch
- Zugabe eines Kristalls des Stoffes, der in der Flüssigkeit gelöst ist – „Impfen“. An den scharfen Kanten der Impfkristalle beginnt dann die Auskristallisation.[2]
- Einbringen von Energie (beispielsweise durch Erschütterungen oder bei Wärmekissen durch Verformungsenergie)
Anwendungsbeispiele
[Bearbeiten | Quelltext bearbeiten]Übersättigte Lösungen werden zum Beispiel zur Reinigung von Stoffen durch Umkristallisation oder überhaupt erst zur Gewinnung von Kristallen (auch Einkristallen:[3]) mittels Kristallisation verwendet.
Übersättigter Dampf
[Bearbeiten | Quelltext bearbeiten]Übersättigter Dampf hat eine höhere Dichte als Dampf im thermodynamischen Gleichgewicht zwischen Dampf und Kondensat. Vor allem in Bezug auf Wasserdampf in der Luft zeigt sich beim Fehlen von Kondensationskernen (Aerosolen) im Laborversuch (Nebelkammer) eine Übersättigung von maximal ca. 800 %. Unter atmosphärischen Bedingungen lassen sich maximale Übersättigungen von 100 % beobachten, wobei in der Regel nur Übersättigungen von wenigen Prozentpunkten auftreten.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Beim langsamen Abkühlen von Dampf im thermodynamischen Gleichgewicht zwischen Dampf und Kondensat entsteht übersättigter Dampf.[4]
Zerlegung am Beispiel von Wolken
[Bearbeiten | Quelltext bearbeiten]Aus unterkühlten Wolkenfeldern lässt sich Regen durch „Impfen“ mit Keimen von z. B.
zur Ausscheidung bringen. Dies kann ggf. erwünscht sein, um Hagelschlag vorzubeugen.[4]
Unterkühlung von Reinstoffschmelzen
[Bearbeiten | Quelltext bearbeiten]Eine weit verbreitete Anwendung, bei der ein breiter Ostwald-Miers-Bereich ausgenutzt wird, sind Handwärmer bzw. Wärmekissen mit Natriumacetat-Trihydrat Füllung.[5] Es wird bei einer Schmelztemperatur von 58 °C verflüssigt, z. B. in der Mikrowelle. Das Material bleibt auch noch bei Temperaturen weit unterhalb des Schmelzpunktes – unter Umständen bis −20 °C – als unterkühlte Schmelze in einem metastabilen Zustand flüssig, da das Salz sich in seinem Kristallwasser löst; die Wassermoleküle bilden eine Art eigenes Kristallgitter, das sich zuerst auflöst.
Zerlegung und Wärmegewinnung
[Bearbeiten | Quelltext bearbeiten]Wird ein Metallplättchen (ähnlich dem in einem Knackfrosch) im Wärmekissen gedrückt, löst das die Kristallisation aus. Das Kissen erwärmt sich dabei wieder auf die Schmelztemperatur, wobei die vollständige Kristallisation und damit die Freigabe der Kristallisationsenthalpie sich über eine längere Zeit erstrecken kann. Als Auslöser für die Kristallisation kommen in Frage:
- die Druckwelle, die durch das Drücken des Metallplättchens ausgelöst wird,
- die dabei verursachte Freisetzung mikroskopisch kleiner Kristallisationskeime, die sich bei jeder Kristallisation in kleinen Ritzen des Metalls festsetzen.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ L. J. Spencer: Biographical notice of Sir Henry A. Miers (1858–1942). In: Journal of the Mineralogical Society. Nr. 185, 1944, S. 17–28 (minersoc.org [PDF]).
- ↑ a b Walter Wittenberger: Chemische Laboratoriumstechnik. 7. Auflage. Springer-Verlag, Wien/ New York 1973, ISBN 3-211-81116-8, S. 100.
- ↑ Arthur Lüttringhaus: Krystallisieren, in Houben-Weyl (Herausgeber: Eugen Müller): Methoden der Organischen Chemie. Band I/1: Allgemeine Laboratoriumspraxis., 4. Auflage. Georg Thieme Verlag, Stuttgart 1958, S. 354–355.
- ↑ a b Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 6: T–Z. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1988, ISBN 3-440-04516-1, S. 4404.
- ↑ Seminarvortrag Daniel Oriwol „Natriumacetat als Latentwärmespeicher“, 2008; PDF-Dokument ( vom 1. Oktober 2011 im Internet Archive).
- ↑ Mansel A. Rogerson, Silvana S. S. Cardoso: Solidification in heat packs: I. Nucleation rate. In: AIChE Journal. 49, 2003, S. 505–515. doi:10.1002/aic.690490220.