Chrom(II)-fluorid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
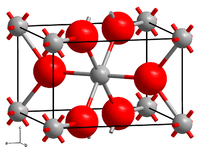
| ||||||||||||||||
| _ Cr2+ _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chrom(II)-fluorid | |||||||||||||||
| Andere Namen |
Chromdifluorid | |||||||||||||||
| Verhältnisformel | CrF2 | |||||||||||||||
| Kurzbeschreibung |
hellgrünes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 89,99 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,11 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
>1300 °C[2] | |||||||||||||||
| Löslichkeit |
wenig löslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Chrom(II)-fluorid ist eine anorganische chemische Verbindung des Chroms aus der Gruppe der Fluoride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Chrom(II)-fluorid kann durch Reaktion von Chrom mit Fluorsalzen von edleren Metallen (z. B. Cadmium(II)-fluorid, Zinn(II)-fluorid oder Bismut(III)-fluorid) gewonnen werden, wobei die Reaktion oberhalb der Schmelztemperatur der Salze ausgeführt wird.[4]
Ebenfalls möglich ist die Herstellung durch Reaktion von Chrom mit Fluorwasserstoff bei etwa 200 °C[4] oder die Reaktion von Chrom(III)-fluorid mit Wasserstoff.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chrom(II)-fluorid ist ein hellgrünes Pulver.[1] Es hat eine monokline Kristallstruktur vom verzerrten Rutil-Typ[6] mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[2] Bei Erhitzung an Luft zersetzt es sich zu Chrom(III)-oxid.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Chromium(II) fluoride, 97% bei Sigma-Aldrich, abgerufen am 16. November 2012 (PDF).
- ↑ a b c d Jean Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Band 3: Elemente, Anorganische Verbindungen und Materialien, Minerale. Springer DE, 1998, ISBN 3-540-60035-3, S. 396 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds. 2. Auflage. Taylor & Francis US, 2011, ISBN 978-1-4398-1461-1, S. 516 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b J. J. Zuckerman: Inorganic Reactions and Methods, The Formation of Bonds to Halogens. John Wiley & Sons, 2009, ISBN 978-0-470-14539-5, S. 178, 182 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1616.
- ↑ Ralf Alsfasser, H. J. Meyer: Moderne anorganische chemie: mit CD-Rom. Walter de Gruyter, 2007, ISBN 978-3-11-019060-1, S. 196 (eingeschränkte Vorschau in der Google-Buchsuche).



