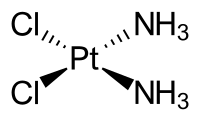
Cisplatin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Cisplatin | ||||||||||||||||||
| Andere Namen |
(SP-4-2)-Diammindichloridoplatin(II) (IUPAC) | ||||||||||||||||||
| Summenformel | [Pt(NH3)2Cl2] | ||||||||||||||||||
| Kurzbeschreibung |
Gelbes, geruchloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 300,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (2,5 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,002 mg·m−3[1] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Cisplatin (cis-Diammindichloridoplatin; DDP) ist ein Arzneistoff (Zytostatikum zur Hemmung des Zellwachstums bzw. der Zellteilung) und enthält ein komplexgebundenes Platinatom. Die Wirkung beruht auf einer Hemmung der DNA-Replikation durch Querverknüpfungen zweier benachbarter Guanin-Basen eines DNA-Strangs. So wird die Struktur der DNA gestört und dadurch funktionsunfähig. Der Zellstoffwechsel kommt zum Erliegen, und die Zelle leitet die Apoptose ein. Wie andere Zytostatika auch wirkt Cisplatin daher nicht nur auf schnellwachsende Tumorzellen, sondern in gewissem Grad auch auf gesunde Körperzellen. Cisplatin ist als Mittel gegen Krebs seit 1978 zugelassen.[2]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Cisplatin wurde zuerst 1844 von Michele Peyrone synthetisiert, damals bekannt als Peyrones Chlorid. Es spielte eine Rolle bei der Entwicklung der Komplexchemie durch Alfred Werner. Die Entdeckung der zytostatischen Wirkung von Platinkomplexen erfolgte in den 1960er Jahren zunächst rein zufällig. Barnett Rosenberg wollte die Wirkung von Wechselstrom auf das Wachstum von Escherichia coli untersuchen. Er benutzte dazu Platinelektroden und stellte dabei fest, dass das Zellwachstum gehemmt wurde. Nach einiger wissenschaftlicher Detektivarbeit wurde als Ursache dafür nicht der Wechselstrom, sondern die Komplexverbindung cis-Diammintetrachloridoplatin(IV), [Pt(NH3)2Cl4], gefunden, die sich aus den vermeintlich inerten Platinelektroden gebildet hatte. Anschließende Versuche mit der am längsten bekannten Komplexverbindung des Platins, dem cis-Diammindichloridoplatin(II), [Pt(NH3)2Cl2], zeigten die gleiche Wirkung bezüglich der Wachstumshemmung. Untersuchungen mit der entsprechenden trans-Verbindung zeigten dagegen keine Wirkung. Das Diammindichloridoplatin(II) war bereits seit 1844 als Peyrones-Salz bzw. als Reisets zweites Chlorid bekannt, wobei spätere Untersuchungen ergaben, dass beide Verbindungen cis- und trans-Isomere waren. Die Existenz der beiden Isomere führten 1894 Alfred Werner zu dem Schluss, dass beide Komplexe eine planare Struktur haben.
In der Krebstherapie wurde Cisplatin erstmals 1974 im Rahmen einer Studie im Universitätsklinikum von Indiana zur Behandlung von Hodenkrebs eingesetzt und führte in den folgenden Jahren bei einer Vielzahl von Patienten zu deutlichen Erfolgen ohne ein Rezidiv. Wegen der zur damaligen Zeit noch nicht so verbreiteten Antiemetika war die Therapie für die Patienten mit einer außerordentlich starken Übelkeit verbunden.[3]
Chemie
[Bearbeiten | Quelltext bearbeiten]Cisplatin stellt einen planaren Komplex dar, der am zentralen Platinatom zwei cis-ständige Chloridliganden und zwei Amminliganden gebunden hat (zur genaueren Erläuterung der Nomenklatur von Komplexverbindungen siehe Komplexchemie). Die Verbindung muss zunächst aktiviert werden, indem intrazellulär durch die niedrigere Chloridkonzentration die Chloridoliganden durch Wasser ersetzt werden, es entstehen dabei durch Hydrolyse unterschiedliche Aqua- und Hydroxido-Komplexe, die teilweise über Hydroxido-Brücken oligomerisieren. Cisplatin wird durch Reaktion von Dikaliumtetrachloridoplatinat(II) (K2[PtCl4]) mit Ammoniak unter Ausnutzung des trans-Effekts dargestellt.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]
Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Cisplatin wirkt ähnlich wie bifunktionelle Alkylantien durch Querverknüpfungen von DNA-Strängen. Der stark elektrophile Aqua-Cisplatin-Komplex reagiert bevorzugt mit den nukleophilsten Stellen der DNA-Basen: Die N7-Atome von Guanin und Adenin. Es entstehen so Verknüpfungen innerhalb eines DNA-Stranges (Intrastrang-Quervernetzung) und zwischen benachbarten DNA-Strängen (Interstrang-Quervernetzungen). Ein weiteres wichtiges Wirkungsprinzip des Cisplatin ist die Auslösung von Punktmutationen. Neben diesen Wirkungen führt Cisplatin auch zur Hemmung der DNA-Reparatur und hemmt die Telomeraseaktivität. Durch diese Wirkungsprinzipien des Cisplatin kommt es zur Anschaltung des programmierten Zelltodes (Apoptose) in schnellteilenden Zellen.
Resistenzmechanismus
[Bearbeiten | Quelltext bearbeiten]Bedeutung für die Resistenzentwicklung sollen intrazelluläre Konzentrationen an Glutathion und die zahlreiche SH-Gruppen tragende Metalloproteine haben, die die Platinverbindungen binden und inaktivieren. Ebenso spielen Transportproteine bei der Resistenzentwicklung eine wichtige Rolle, z. B. CTR1 – ein Transportprotein, das normalerweise für die Aufnahme von Kupfer in die Zelle verantwortlich ist. Auch eine vermehrte DNA-Reparatur soll beteiligt sein. Zu beachten ist die Kreuzresistenz mit Carboplatin.
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Cisplatin würde bei oraler Aufnahme von der Magensäure hydrolysiert werden, daher wird es intravenös appliziert. Es wird zu 90 % an Serumproteine (z. B. Albumin) gebunden und unterliegt einer dreiphasigen Eliminationskinetik (talpha = 20–30 min, tbeta = 40–70 min, tgamma = 24 h). In der tertiären Phase wird das plasmaproteingebundene Cisplatin eliminiert. Die Verteilung von Cisplatin zeigt besonders hohe Konzentrationen in Nieren, Leber, Gonaden, Milz, Prostata, Harnblase, Pankreas, Muskulatur und Nebennieren. Die Aufnahme ins Gehirn und in den Liquor cerebrospinalis ist gering.
Indikation
[Bearbeiten | Quelltext bearbeiten]Hauptanwendungsgebiete für Cisplatin sind das Hoden-, Ovarial-, Bronchial-, Harnblasen- und Zervixkarzinom und Plattenepithelkarzinome an Kopf und Hals sowie das Chorionkarzinom. Cisplatin wird als Infusion verabreicht und kommt fast ausschließlich in Kombination mit anderen Chemotherapeutika zum Einsatz (Kombinations-Chemotherapie).
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]- Cisplatin gehört zu den Zytostatika, die am häufigsten zu Übelkeit, Erbrechen und Durchfall führen. Mittels der modernen Antiemetika wie 5-HT3-Antagonisten (z. B. Ondansetron) und Aprepitant lässt sich diese sehr unangenehme Nebenwirkung heute allerdings recht gut beeinflussen.
- Dosislimitierende Nierenschädigung (etwa 2. Woche nach Therapiebeginn).[5] Durch verstärkte Diurese und ausreichende Flüssigkeitszufuhr vor, während und nach der Anwendung kann die Nephrotoxizität verringert werden. Diuretika, vor allem Schleifendiuretika verstärken die Nephrotoxizität und sind daher kontraindiziert.
- Hörschäden[6] in den höheren Frequenzen (vor allem bei Kindern).
- Nach wiederholter Gabe evtl. periphere Neuropathie mit Parästhesien, Krämpfen und Verlust motorischer Funktionen.
- Myelosuppression
- In seltenen Fällen anaphylaktoide Reaktionen (Anaphylaxie).
Die negativen Auswirkungen von Cisplatin auf die gesunden Zellen einiger Organe, wie beispielsweise die Nieren, lassen sich durch den zugelassenen Zytoprotektor Amifostin teilweise unterdrücken.[7][8][9][10]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Cis-GRY (D), Platiblastin (CH), Platinol (CH), zahlreiche Generika (D, A, CH).[11][12][13]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Markus Galanski, Bernhard K. Keppler: Tumorhemmende Metallverbindungen. In: Pharmazie in unserer Zeit 35(2), S. 118–122 (2006), doi:10.1002/pauz.200500160.
- Ingo Ott, Ronald Gust: Medizinische Chemie der Platinkomplexe: Besonderheiten anorganischer Zytostatika. In: Pharmazie in unserer Zeit 35(2), 2006, S. 124–133, doi:10.1002/pauz.200500161.
- Wieland Voigt, Andrea Dietrich, Hans-Joachim Schmoll: Cisplatin und seine Analoga. In: Pharmazie in unserer Zeit 35(2), 2006, S. 134–143, doi:10.1002/pauz.200500162.
- Bernhard Lippert (Ed.): Cisplatin, Chemistry and Biochemistry of a Leading Anticancer Drug. Wiley-VCH, 1999, ISBN 3-906390-20-9.
- Bernhard Lippert, Wolfgang Beck: Platin-Komplexe in der Krebstherapie. In: Chemie in unserer Zeit, 17. Jahrg. 1983, Nr. 6, S. 190–199, doi:10.1002/ciuz.19830170604.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Cisplatin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Januar 2020. (JavaScript erforderlich)
- ↑ FDA Oncology Tools Approval Summary for cisplatin for Metastatic ovarian tumors. ( vom 8. Februar 2008 im Internet Archive) fda.gov; abgerufen am 21. Oktober 2010.
- ↑ Siddhartha Mukherjee: Der König aller Krankheiten: Krebs – eine Biografie. DuMont Buchverlag, Köln 2012, ISBN 978-3-8321-9644-8.
- ↑ B. Lippert (Hrsg.): CISPLATIN – Chemistry and Biochemistry of a Leading Anticancer Drug. 1999, WILEY-VCH, S. 84–85.
- ↑ K. K. Filipski, R. H. Mathijssen u. a.: Contribution of organic cation transporter 2 (OCT2) to cisplatin-induced nephrotoxicity. In: Clinical Pharmacology and Therapeutics. Band 86, Nummer 4, Oktober 2009, S. 396–402, doi:10.1038/clpt.2009.139. PMID 19625999. PMC 2746866 (freier Volltext).
- ↑ S. Waissbluth, S. J. Daniel: Cisplatin-induced ototoxicity: Transporters playing a role in cisplatin toxicity. In: Hearing research. Band 299, Mai 2013, S. 37–45, doi:10.1016/j.heares.2013.02.002. PMID 23467171.
- ↑ J. M. Yuhas, J. M. Spellman, F. Culo: The role of WR-2721 in radiotherapy and/or chemotherapy. In: Cancer Clinical Trials Band 3, Nummer 3, 1980, S. 211–216, PMID 6254681.
- ↑ Amifostin zur Zytoprotektion gegen Nebenwirkungen der Kombinationstherapie mit Cyclophosphamid und Cisplatin bei Patientinnen mit Ovarialkarzinom. ( vom 23. Januar 2011 im Internet Archive) In: Der Arzneimittelbrief, Band 31, 1997, 6b.
- ↑ L. G. Marcu: The role of amifostine in the treatment of head and neck cancer with cisplatin-radiotherapy. In: European Journal of Cancer Care Band 18, Nummer 2, März 2009, S. 116–123, doi:10.1111/j.1365-2354.2008.01032.x. PMID 19267726. (Review).
- ↑ M. Treskes, U. Holwerda, I. Klein, H. M. Pinedo, W. J. van der Vijgh: The chemical reactivity of the modulating agent WR2721 (ethiofos) and its main metabolites with the antitumor agents cisplatin and carboplatin. In: Biochemical pharmacology Band 42, Nummer 11, November 1991, S. 2125–2130, PMID 1659819.
- ↑ Rote Liste online, Stand: September 2009.
- ↑ AM-Komp. d. Schweiz, Stand: September 2009.
- ↑ AGES-PharmMed, Stand: September 2009.