Methylnaltrexon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
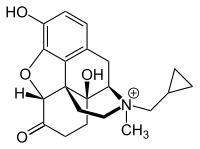
| ||||||||||||||||||||||
| Gegenion nicht abgebildet | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Methylnaltrexon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Methylnaltrexon, MNTX (Handelsname Relistor®; Hersteller Wyeth) ist ein Arzneistoff zur Behandlung von durch Opioiden ausgelöste Verstopfung (Obstipation). Er wird im fortgeschrittenen Krankheitsstadium eingesetzt, wenn die Wirkung der üblichen Abführmittel nicht ausreicht.
Methylnaltrexon ist ein quartäres Derivat des Opioidantagonisten Naltrexon und der erste Vertreter eines neuen Wirkprinzips zur ursächlichen Therapie der Opioid-induzierten Obstipation {engl.: Opioid-Induced Constipation (OIC)}.[2]
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Bei der Anwendung von stark wirksamen Opioid-Analgetika in der palliativen Schmerztherapie stellt die Opioid-induzierte Obstipation eine große klinische Herausforderung dar. Spastische Obstipationen des Darms (Verstopfung) werden durch die Stimulierung von μ-Rezeptoren des Plexus myentericus der Darmwand mit einer Konstriktion der glatten Muskulatur bewirkt. Sie sind die relevanteste Nebenwirkung bei langfristiger Schmerzbehandlung und unterliegt – im Gegensatz zu anderen durch Opioide bedingten Nebenwirkungen – nur einer geringen Toleranzentwicklung (starke Gewöhnung an Opioide mit Dosissteigerung bis um das Zwanzigfache).[3]
Anwendungsgebiete (Indikationen)
[Bearbeiten | Quelltext bearbeiten]Behandlung von Patienten in fortgeschrittenen Krankheitsstadien, die eine palliative Behandlung und eine dauerhafte Therapie mit Medikamenten aus der Wirkstoffgruppe der Opioide erhalten, die eine Opioid-induzierter Obstipation auslösen und das Ansprechen auf eine konventionelle Laxantientherapie unzureichend ist. MNTX wird zusätzlich zum Abführmittel verabreicht.[4]
Dosierung, Art und Dauer der Anwendung
[Bearbeiten | Quelltext bearbeiten]Methylnaltrexon wird subkutan verabreicht. Die Dosierung ist abhängig vom Körpergewicht des Patienten, sie beträgt üblicherweise 8 mg des Wirkstoffs für Patienten mit einem Gewicht von 38 bis 61 kg, oder 12 mg für Patienten mit einem Gewicht von 62 bis 114 kg. Die Dosis wird alle 48 Stunden als Injektion unter die Haut gegeben, entweder in den Oberschenkel, in das Abdomen (den Bauch) oder in den Oberarm. Eine altersabhängige Dosisanpassung ist nicht notwendig, und MNTX kann unabhängig von Mahlzeiten angewendet werden.
Die Wirkung von MNTX wurde an Patienten mit Opioid-induzierter Obstipation untersucht und ist nicht angezeigt bei der nicht Opioid-bedingten Verstopfung.
Gegenanzeigen (Kontraindikationen)
[Bearbeiten | Quelltext bearbeiten]Die Anwendung von Methylnaltrexonbromid bei Patienten mit bekanntem oder vermutetem mechanischen gastrointestinalen Verschluss, wie Darmverschluss (Ileus), und bei akutem chirurgischen Abdomen, ist kontraindiziert, ebenso bei einer Überempfindlichkeit auf den Wirkstoff.
Anwendung während Schwangerschaft und Stillzeit
[Bearbeiten | Quelltext bearbeiten]Es liegen keine Erfahrungen mit hinreichenden Daten für die Verwendung von Methylnaltrexonbromid in der Schwangerschaft vor. Tierexperimentelle Studien haben bei hohen Dosen eine Reproduktionstoxizität gezeigt. Das potentielle Risiko für den Menschen ist nicht bekannt. Relistor sollte in der Schwangerschaft möglichst nicht angewendet werden.[5]
Es ist nicht bekannt, ob der Wirkstoff beim Stillen in die Muttermilch ausgeschieden wird. Tierexperimentelle Studien haben eine Ausscheidung von Methylnaltrexonbromid in die Muttermilch gezeigt.
Besondere Patientengruppen
[Bearbeiten | Quelltext bearbeiten]Eine Behandlung mit Relistor wird bei Patienten mit schwerer Leberfunktionsstörung oder Dialyse-Patienten mit terminaler Nierenfunktionsstörung nicht empfohlen, da dazu keine Daten vorliegen. Der Arzneistoff soll nicht zur Behandlung von Kindern und Jugendlichen unter 18 Jahren angewendet werden, da in dieser Altersgruppe keine ausreichenden Erfahrungen vorliegen.[5]
Unerwünschte Wirkungen (Nebenwirkungen)
[Bearbeiten | Quelltext bearbeiten]Bei allen Probanden, die an Placebokontrollierten Studien teilnahmen, waren die mit dem Arzneimittel verbundenen Nebenwirkungen folgende: Sehr häufig traten abdominaler Schmerz, Übelkeit, Durchfall und Flatulenz (Blähungen) auf. Häufig wurden Vertigo (Schwindel) sowie allgemeine Beschwerden an der Injektionsstelle, wie beispielsweise Stechen, Brennen, Schmerz, Rötung, Ödem beobachtet.[5]
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Wirkungsmechanismus (Pharmakodynamik)
[Bearbeiten | Quelltext bearbeiten]Methylnaltrexonbromid ist ein kompetitiver Antagonist der Opioid-Bindung am µ-Opioidrezeptor. In-vitro-Studien zeigten, dass Methylnaltrexon am µ-Rezeptor eine Hemmkonstante von Ki = 28 nM hat, mit einer 8-fach geringeren Wirkung auf κ-Opioidrezeptoren (Ki = 203 nM) und einer stark reduzierten Affinität zu δ-Opioidrezeptoren. Da es ein stark polares quartäres Amin mit einem ausgeprägten hydrophilen Charakter ist, ist Methylnaltrexon nicht fähig, die Blut-Hirn-Schranke in das stark fetthaltige Gewebe des Gehirns zu überwinden. Dies erlaubt es Methylnaltrexon, als peripher wirkender Antagonist des µ-Opioidrezeptors in Geweben wie dem Verdauungstrakt seine Wirkung selektiv zu entfalten, ohne die analgetische Wirkung im zentralen Nervensystem zu beeinflussen.[6][7]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
[Bearbeiten | Quelltext bearbeiten]Resorption: Nach subkutaner Injektion wird Methylnaltrexonbromid rasch resorbiert, und Spitzenkonzentrationen werden nach etwa 0,5 Stunden erreicht. Die und die AUC steigen bei einer Erhöhung der Dosis von 0,15 mg/kg auf 0,5 mg/kg dosisproportional an. Die absolute Bioverfügbarkeit einer subkutanen 0,30 mg/kg Dosis im Vergleich zu einer intravenösen 0,30 mg/kg Dosis liegt bei 82 %. Verteilung: Methylnaltrexon unterliegt einer geringen Gewebeverteilung. Das Verteilungsvolumen im „steady state“ liegt bei etwa 1,1 Liter/kg. Die Plasmaproteinbindung von Methylnaltrexon ist gering und beträgt 11,0 % bis 15,3 %. Metabolismus: Methylnaltrexon wird – bezogen auf die Menge an Metaboliten, die in den Exkrementen wiedergefunden werden – nur mäßig verstoffwechselt. Die Biotransformation zu Methyl-6-Naltrexol-Isomeren und Methylnaltrexonsulfat scheint der primäre Metabolismus-Pfad zu sein. Jedes der Methyl-6-Naltrexol-Isomere hat eine etwas geringere antagonistische Aktivität als die Ausgangsverbindung und mit etwa 8 % der Arzneimittel-bezogenen Stoffe ein geringes Auftreten im Plasma. Methylnaltrexonsulfat ist ein inaktiver Metabolit und liegt im Plasma bei etwa 25 % der Arzneimittel-bezogenen Stoffe. N-Demethylierung von Methylnaltrexon zur Bildung von Naltrexon ist nicht signifikant und macht 0,06 % der gegebenen Dosis aus. Elimination: Methylnaltrexon wird vorwiegend als unveränderte aktive Substanz ausgeschieden. Etwa die Hälfte der Dosis wird renal mit dem Urin ausgeschieden und etwas weniger über die Fäzes. Die terminale Halbwertszeit t1/2 der Verfügbarkeit beträgt annähernd 8 Stunden.[7][8]
Sonstige Informationen
[Bearbeiten | Quelltext bearbeiten]Chemische und pharmazeutische Informationen
[Bearbeiten | Quelltext bearbeiten]Als Arzneistoff wird ausschließlich die quartäre Ammoniumverbindung mit Bromid als Gegenion, und dem internationalen Freinamen Methylnaltrexoniumbromid, verwendet. Es ist das N-methylierte Derivat des zentral und peripher wirksamen Antagonisten Naltrexon. Die Methylierung erhöht deutlich die Polarität des Moleküls und verleiht ihm dadurch einen hydrophilen Charakter.
Entwicklung und Vermarktung
[Bearbeiten | Quelltext bearbeiten]MNTX-ähnliche Arzneistoffe wurden erstmals von den Chemikern Leon I. Goldberg (USA), Herbert Merz (DE) und Klaus Stockhaus (DE) synthetisiert und 1979 durch Boehringer Ingelheim (DE) als Patent mit dem Titel: Quaternary derivatives of noroxymorphone which relieve intestinal immobility veröffentlicht.[9]
Die amerikanische Wyeth Pharmaceuticals Inc., eine Sparte des weltweit zehntgrößten Pharmakonzerns Wyeth, gab am 23. Dezember 2005 bekannt, dass sie mit der Progenics Pharmaceuticals Inc. ein Abkommen zur Entwicklung und Vermarktung von Methylnaltrexon, eines Medikaments gegen Magen-Darm-Beschwerden, geschlossen hat. Im Rahmen des Abkommens erhielt Wyeth Pharmaceuticals die weltweiten Rechte für Methylnaltrexon, während Progenics eine Option zur Co-Vermarktung des Produkts in den USA behielt. Wyeth leistete dabei eine Vorauszahlung in Höhe von 60 Millionen Dollar an Progenics, wobei zusätzlich „Meilenstein-Zahlungen“ von bis zu 356,5 Millionen Dollar folgen können.
Anfang Juli 2008 erteilte die Europäische Kommission die Marktzulassung für eine Methylnaltrexon-haltige Injektionslösung in der Europäischen Union. Als erstes Land hat Deutschland das Arzneimittel eingeführt.[10] Bereits im April 2008 wurde das Arzneimittel von der Food and Drug Administration (FDA) in den Vereinigten Staaten zugelassen.[11]
Eine orale Formulierung von MNTX zur Behandlung der Opioid-induzierten-Obstipation sowie eine intravenöse Darreichungsform von MNTX zur Therapie des post-operativen Ileus (POI) befinden sich in der klinischen Phase II.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Ernst Mutschler u. a.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1.
- Patent EP0938316: Galenic Composition Containing Opioid Antagonists. Veröffentlicht am 1. September 1999.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Methylnaltrexon
- Übersicht der 13 Studien von Progenics. ClinicalTrials.gov
- Übersicht der 13 Studien von Progenics nach geographischer Region. ClinicalTrials.gov
- A Double-Blind, Placebo-Controlled Study of Methylnaltrexone (MNTX) for the Relief of Constipation Due to Chronic Opioid Therapy in Patients with Advanced Medical Illness (PDF; 209 kB)
- A Three-Month Open-Label Treatment Extension of Protocol MNTX 302. (PDF; 115 kB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Morfinan, 17-(ciclopropilmetil)-4,5-epossi-3,14-diidrossi-17-metil-6-osso-, bromuro, (5a)- im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Juli 2020.
- ↑ P. Holzer: Treatment of opioid-induced gut dysfunction. In: Expert Opin Investig Drugs, Band 16, Nr. 2, Feb 2007, S. 181–194. PMID 17243938
- ↑ E. Freye, L. Latasch: Toleranzentwicklung unter Opioidgabe – Molekulare Mechanismen und klinische Bedeutung. In: Anasthesiol Intensivmed Notfallmed Schmerzther, Band 38, Nr. 1, Jan 2003, S. 14–26. PMID 12522725
- ↑ L. Shaiova u. a.: A review of methylnaltrexone, a peripheral opioid receptor antagonist, and its role in opioid-induced constipation. In: Palliat Support Care, Band 5, Nr. 2, Jun 2007, S. 161–166. PMID 17578067
- ↑ a b c Relistor: Zusammenfassung der Merkmale des Arzneimittels, Stand: Juli 2008 auf der Website der Europäischen Arzneimittelagentur (EMEA)
- ↑ C. S. Yuan u. a.: Methylnaltrexone prevents morphine-induced delay in oral-cecal transit time without affecting analgesia: a double-blind randomized placebo-controlled trial. In: Clin Pharmacol Ther. Band 59, Nr. 4, Apr 1996, S. 469–475. PMID 8612393
- ↑ a b Englische Fachinformation für Relistor 12 mg/0,6 ml Injektionslösung von Wyeth-USA – Stand der Information: April 2008. (Seite nicht mehr abrufbar, festgestellt im Mai 2019. Suche in Webarchiven)
- ↑ C. S. Yuan u. a.: Effects of subcutaneous methylnaltrexone on morphine-induced peripherally mediated side effects: a double-blind randomized placebo-controlled trial. In: J Pharmacol Exp Ther. Band 300, Nr. 1, Jan 2002, S. 118–123. PMID 11752106 Volltext HTML
- ↑ Patent US4176186: Quaternary derivatives of noroxymorphone which relieve intestinal immobility. Veröffentlicht am 27. September 1979.
- ↑ Erster selektiver μ-Opioid-Rezeptor-Antagonist Methylnaltrexon (Relistor®) erhält Zulassung für Europa (PDF) Wyeth Pressemitteilung vom 7. Juli 2008.
- ↑ Progenics and Wyeth Announce FDA has Approved Relistor – First Drug for Opioid-Induced Constipation to Launch in United States ( vom 17. September 2017 im Internet Archive). Wyeth Pressemitteilung vom 24. April 2008, abgerufen am 17. September 2017.
