Polysulfone

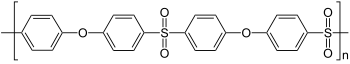
Polysulfone sind eine Klasse thermoplastischer Hochleistungskunststoffe. Sie sind bekannt für ihre Zähigkeit und Stabilität bei hohen Temperaturen. Technisch verwendete Polysulfone enthalten eine Aryl-SO2-Aryl-Untereinheit. Aufgrund hoher Material- und Verarbeitungskosten werden Polysulfone nur in speziellen Anwendungen benutzt, häufig als überlegene Alternative zu Polycarbonaten.
Drei Polysulfone finden technische Anwendung, dies sind Polysulfon (PSU), Polyethersulfon (PES) und Polyphenylensulfon (PPSU). Sie sind im Temperaturbereich von −100 °C bis +200 °C einsetzbar und werden für elektrische Geräte, im Fahrzeugbau und der Medizintechnik verwendet.[1] Sie sind aufgebaut aus paraverknüpften Aromaten, Sulfon- und Ethergruppen und teils auch Alkylgruppen.
Polysulfone verfügen über herausragende Wärme- und Oxidationsbeständigkeit, hydrolysebeständig gegen wässrige und alkalische Medien und gute elektrische Eigenschaften.[2][3]
Definition und technisch verwendete Polysulfone
[Bearbeiten | Quelltext bearbeiten]Prinzipiell könnte jedes Polymer, das eine Sulfongruppe enthält, als "Polysulfon" bezeichnet werden. Wenn von „Polysulfonen“ die Rede ist, sind jedoch meist Polyarylethersulfone (PAES) gemeint, da ausschließlich aromatische Polysulfone als technischer Werkstoff Verwendung finden. Da außerdem in den technisch verwendeten Polysulfonen stets Ethergruppen vorhanden sind, werden PAES auch als Poly(arylensulfon)e, als Polyethersulfone (PES) oder schlicht Polysulfon (PSU) bezeichnet. Die drei Bezeichnungen (und Abkürzungen) können daher Synonyme sein. Als Bezeichnung für alle Polysulfone ist „Poly(arylethersulfon)e (PAES)“ daher zu bevorzugen, da Polysulfon (PSU), Polyethersulfon (PES) und Poly(arylensulfon) (PAS) zusätzlich als Name für einzelne Polymere benutzt werden. Diese und einige weitere PAES sind in der Tabelle im Kapitel Technisch relevante Polysulfone aufgeführt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Das einfachste Polysulfon Poly(phenylensulphon) war bereits vor 1960 bekannt. Es lässt sich in einer Friedel-Crafts-Reaktion aus Phenylsulfonchlorid darstellen:[4]
Da dieses Polymer einen Schmelzpunkt von über 500 °C besitzt ist es zwar auf einen Seite sehr wärmebeständig, auf der anderen jedoch gleichzeitig nur sehr schwer zu verarbeiten. Außerdem sind seine mechanischen Eigenschaften eher schlecht. Daher wurde zu dieser Zeit an thermoplastisch (aus der Schmelze) verarbeitbaren Polysulfonen geforscht. Es wurde bereits vermutet, dass sich hierzu Polyarylethersulfe (PAES) eignen würden.
Entsprechende Synthesewege zu PAES wurden fast gleichzeitig und trotzdem unabhängig voneinander von 3M Corporation,[5] von Union Carbide Corporation[6] in den USA und in der Plastics Division von ICI[7] in Großbritannien entwickelt. Die damals gefundenen Polymere werden auch heute noch verwendet, jedoch über ein anderes Syntheseverfahren hergestellt.
Das damals verwendete Syntheseverfahren verlief über eine elektrophile Synthese. Dabei wurden nicht nur para-, sondern auch ortho-Bindungen erzeugt, was stellenweise zu Vernetzung und generell zu schlechteren mechanischen Eigenschaften führte.[8][5]
Die Synthesen bestanden aus einer elektrophilen aromatischen Substitution eines Arylethers mit einem Sulfurylchlorid unter Verwendung eines Friedel-Crafts-Katalysators (z. B. Eisen(III)-chlorid, Antimon(V)-chlorid):
Alle heute kommerziell verfügbaren PAES werden nicht über diese, sondern eine nukleophile Synthese dargestellt, siehe Kapitel Herstellung.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Technisch werden Polyethersulfone durch eine Polykondensations-Reaktionen einer aromatischen Dihydroxykomponente (z. B. das Natriumsalz des Bisphenol A) und eines Bis(halophenyl)-sulfons dargestellt. Das Natriumsalz der Dihydroxykomponente wird in situ durch eine Reaktion mit der stöchiometrischen Menge Natriumhydroxid (NaOH) gebildet.
Das dabei entstehende Wasser muss mit einem azeotropen Lösungsmittel (z. B. Methylbenzol oder Chlorbenzol) entfernt werden, da es sonst Probleme bereitet. Die Polymerisation erfolgt bei 130–160 °C unter inerten Bedingungen in einem polaren, aprotischen Lösemittel, z. B. Dimethylsulfoxid:
Als bis(halophenyl)-Sulfon können Difluoride eingesetzt werden; sie sind reaktionsfähiger als Dichloride, aber für den kommerziellen Einsatz zu teuer. Durch Kettenabbrecher (Chlormethan) kann die Kettenlänge in einen Bereich reguliert werden, dass eine technische Schmelzverarbeitung möglich ist. Das Produkt nach der unteren Reaktionsgleichung besitzt jedoch noch reaktive Endgruppen. Um zu verhindern, dass es in der Schmelze zu weiterer Kondensation kommt, werden die Endgruppen z. B. mit Chlormethan verethert.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Polysulfone sind amorphe Kunststoffe, die starr, hochfest und sehr transparent sind. Sie zeichnen sich außerdem durch hohe Festigkeit, Steifheit und Härte aus und behalten diese Eigenschaften auch zwischen −100 und 150 °C bei. Die Glastemperatur von Polysulfonen liegt bei 190 bis 230 °C.[9] Die Formstabilität ist sehr hoch, die Größenänderung bei Kontakt mit kochendem Wasser, mit 150 °C heißer Luft oder Dampf liegt bei weniger als 0,1 %.[10]
Polysulfone zeichnen sich außerdem durch gute Chemikalienbeständigkeit aus. Sie sind sehr beständig gegenüber Mineralsäuren und Laugen (in einem pH-Bereich von 2 bis 13) sowie gegenüber Elektrolyten. Sie sind nicht beständig gegenüber unpolaren organischen Lösungsmitteln (z. B. Ketone und chlorierte Kohlenwasserstoffe) und aromatischen Kohlenwasserstoffen, sie lösen sich in Dichlormethan und Methylpyrrolidon.[11]
Polysulfone werden zu den Hochleistungskunststoffen gezählt. Sie können durch Spritzgießen, Extrudieren oder Warmumformen verarbeitet werden.
Struktur-Eigenschafts-Beziehung
[Bearbeiten | Quelltext bearbeiten]Poly(arylethersulfon)e sind aus Aromaten, Ethergruppen und Sulfonsäuregruppen aufgebaut. Als Vergleich für die Funktion der einzelnen Bestandteile kann Poly(phenylensulphon) dienen, welches nur aus Sulfonsäuregruppen und Phenylgruppen besteht. Da beide Gruppen thermisch sehr stabil sind, besitzt Poly(phenylensulphon) eine äußerst hohe Schmelztemperatur (520 °C). Die Polymerketten sind jedoch gleichzeitig so starr, dass Poly(phenylensulphon) (PAS) sich vor dem Schmelzen zersetzt und damit nicht thermoplastisch verarbeitet werden kann. Daher müssen flexible Elemente mit in die Ketten eingebaut werden, dies geschieht in Form von Ethergruppen. Sie erlauben eine freie Drehbarkeit der Polymerketten. Dies führt zu einem deutlich verringerten Schmelzpunkt und verbessert zudem die mechanischen Eigenschaften durch eine erhöhte Schlagzähigkeit.[8] Die Alkylgruppen in Bisphenol A wirkt ebenfalls als flexibles Element. Die Ursache für die Stabilität des Polymers lässt sich ebenfalls auf die einzelnen strukturelle Elemente zurückführen:
Die Sulfongruppe, in der sich Schwefel in der höchstmöglichen Oxidationsstufe befindet, zieht Elektronen von den benachbarten Benzolringen an und verursacht dort so Elektronenmangel. Das Polymer widersetzt sich daher einem weiteren Elektronenverlust, wodurch die hohe Oxidationsbeständigkeit begründet wird. Die Sulfongruppe ist außerdem durch Mesomerie über eine starke Bindung mit dem Aromaten verknüpft (Bindung verstärkt durch Mesomerieenergie). Dadurch können größere Mengen Energie aus Wärme oder Strahlung von der Molekülstruktur aufgenommen werden, ohne dass es zu Reaktionen (Zersetzung) kommt. Die Mesomerie hat außerdem zur Folge, dass die Konfiguration besonders starr ist. Durch die Diphenylsulfongruppe ist das Polymer also dauerwärmebeständig, oxidationsbeständig und besitzt auch bei erhöhten Temperaturen noch eine hohe Steifigkeit. Die Ether-Bindung liefert (im Gegensatz zu Estern) Hydrolysebeständigkeit sowie eine gewisse Flexibilität, die zu Schlagzähigkeit führt. Außerdem führt die Ether-Bindung zu guter Wärmebeständigkeit und besserer Fließfähigkeit in der Schmelze.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Polysulfon hat eine der höchsten Betriebstemperaturen aller Thermoplaste, die sich aus der Schmelze verarbeiten lassen. Durch seine Beständigkeit bei hohen Temperaturen kann es als Flammschutzmittel eingesetzt werden, ohne dass durch seinen Einsatz die mechanischen Eigenschaften verschlechtert werden würden (wie bei vielen anderen Flammschutzmitteln der Fall). Seine hohe Hydrolysestabilität erlaubt den Einsatz in medizinischen Anwendungen, die Sterilisation im Autoklaven erfordern. Es ist jedoch anfällig gegenüber einigen Lösungsmitteln und Verwitterung; die Instabilität gegenüber Verwitterung kann jedoch durch Zugabe anderer Materialien ausgeglichen werden.
Polysulfone ermöglichen die einfache Herstellung von Membranen mit reproduzierbaren Eigenschaften und kontrollierbarer Porengröße, bis zu 40 Nanometern. Solche Membranen können in Anwendungen wie Hämodialyse, Abwasserrückgewinnung, Lebensmittel- und Getränkeverarbeitung sowie Gastrennung verwendet werden. Sie werden auch in der Automobil- und Elektronikindustrie eingesetzt. Filterpatronen, die aus Polysulfonmembranen gemacht werden, bieten eine extrem hohe Flussraten auch bei sehr niedriger Druckdifferenz, verglichen mit Nylon oder Polypropylen.
Polysulfone können mit Glasfasern verstärkt sein. Der resultierende Verbundwerkstoff hat die doppelte Zugfestigkeit und einen dreimal so hohen Elastizitätsmodul.
Technisch relevante Polysulfone
[Bearbeiten | Quelltext bearbeiten]Einige technisch relevante Polysulfone sind in der folgenden Tabelle aufgeführt:
| Strukturformel | Name (Markenname, Firma) | Chemischer Name | CAS |
|---|---|---|---|
| Polyarylensulfon (PAS) | |||
| Polybisphenylsulfon (PSF) | Poly[oxy-1,4-phenylensulfonyl-1,4-phenylenoxy-1,4-phenylen(1-methylethyliden)-1,4-phenylen] | 25135-51-7 | |
| Polyethersulfon (PES) | Poly(oxy-1,4-phenylsulfonyl-1,4-phenyl) | 25608-63-3 | |
| Polyphenylensulfon (PPSU) | 25608-64-4 | ||
| Polysulfon (PSU) | Poly(oxy-1,4-phenylenesulfonyl-1,4-phenylene) | 25667-42-9 | |
| Victrex HTA | 121763-41-5 |
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Wolfgang Kaiser: Kunststoffchemie für Ingenieure: Von der Synthese bis zur Anwendung. 2. Auflage. Carl Hanser, 2007, ISBN 978-3-446-41325-2, S. 461.
- ↑ a b R. Becker, Ludwig Bottenbruch, Rudolf Binsack, Gerhard W. Becker, Dietrich Braun: Hochleistungskunststoffe. Polyarylate, Thermotrope, Polyester, Polyimide, Polyetherimide, Polyamidimide, Polyarylensulfide, Polysulfone, Polyetheretherketone. Kunststoff-Handbuch Band 3/3: Technische Thermoplaste. Hrsg.: Gerhard W. Becker, Dietrich Braun, Ludwig Bottenbruch. Band 3/3. Hanser, München [u. a.] 1994, ISBN 3-446-16370-0, S. 140 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Johannes Karl Fink: High Performance Polymers (= Industrial polymer technology and applications). Andrew, Norwich NY 2008, ISBN 978-0-8155-1580-7, S. 453–481 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Manfred D. Lechner, Klaus Gehrke, Eckhard Nordmeier: Makromolekulare Chemie: ein Lehrbuch für Chemiker, Physiker, Materialwissenschaftler und Verfahrenstechniker. 4. Auflage. Birkhäuser, Basel / Boston MA / Berlin 2010, ISBN 978-3-7643-8890-4, S. 134 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Patent GB1060546: Polyarylsulphone polymers. Anmelder: MINNESOTA MINING & MFG, Erfinder: H.A. Vogel.
- ↑ Patent GB1078234: Polyarylene Polyethers. Angemeldet am 1973, Anmelder: Union Carbide Corporation, Erfinder: Alford G. Farnham, Robert N. Johnson.
- ↑ Patent GB1153035: Production of Aromatic Polymers and Intermediates therefor. Anmelder: ICI LTD, Erfinder: BARR DENNIS ARTHUR; ROSE JOHN BREWSTER.
- ↑ a b J.B. Rose: Preparation and properties of poly(arylene ether sulphones). In: Polymer. 15. Jahrgang, Nr. 7, Juli 1974, S. 456–465, doi:10.1016/0032-3861(74)90111-6.
- ↑ Handbook of Biomaterial Properties. Springer Science & Business Media, 1998, ISBN 978-0-412-60330-3, S. 283 (books.google.de).
- ↑ Hee-Gweon Woo, Hong Li: Advanced Functional Materials. Springer Science & Business Media, 2011, ISBN 978-3-642-19077-3, S. 23 (books.google.de).
- ↑ David Parker, Jan Bussink, Hendrik T. van de Grampel, Gary W. Wheatley, Ernst-Ulrich Dorf, Edgar Ostlinning, Klaus Reinking, "Polymers, High-Temperature" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH: Weinheim. doi:10.1002/14356007.a21_449
![{\displaystyle \mathrm {Ar-SO_{2}-Cl\longrightarrow -[-Ar-SO_{2}-]_{n}+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cff5694b952876992b1d382e5d280809bdc5e113)

