6-Methyl-5-hepten-2-on
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 6-Methyl-5-hepten-2-on | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H14O | ||||||||||||||||||
| Kurzbeschreibung |
farblos bis gelblich Flüssigkeit mit süßlichem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 126,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,85 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (3,02 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,435–1,445 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
6-Methyl-5-hepten-2-on ist eine organisch-chemische Verbindung aus der Stoffgruppe der Ketone, genauer der Alkenone. Es ist als wichtiges Zwischenprodukt bei der Herstellung verschiedener Aromachemikalien von technischer Bedeutung.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]6-Methyl-5-hepten-2-on ist eines der wichtigsten flüchtigen Aromen von Tomaten.[5] Die Verbindung wurde ursprünglich im Zitronengras identifiziert, wurde aber in den ätherischen Ölen von Palmarosa, Zitronen, Eisenkraut, Geranien und anderen nachgewiesen. Ebenfalls wurde sie in Früchten (wie zum Beispiel Äpfeln, Aprikosen, Süß- und Sauerkirsche), aber auch in vielen weiteren Pflanzenprodukten (wie zum Beispiel Heidelbeeren, Preiselbeeren, Kartoffeln, Ingwer, Kakao, Tee, Sternfrucht, Reis und weiteren) nachgewiesen.[3] Einige Bienenarten geben die Verbindung ab, wobei andere auf diese Substanz reagieren.[6]
-
Zitronengras
-
Tomaten
-
Apfel der Sorte James Grieve
-
Getrocknete Aprikosen
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur industriellen Synthese von 6-Methyl-5-hepten-2-on sind zahlreiche Verfahren bekannt, die sich vor allem im Punkt Rohstoffauswahl unterscheiden. Viele der technisch genutzten Verfahren beruhen auf petrochemischen Ausgangsstoffen und sind somit vollkommen synthetisch. Die Extraktion aus Zitronengrasöl oder Citral in wässriger Lösung mit Kaliumcarbonat und anschließender Destillation und Vakuumfraktionierung hat nur wenig Bedeutung.[3]
Hoffmann-La Roche / DSM-Prozess
[Bearbeiten | Quelltext bearbeiten]Ausgehend von Aceton (1), welches unter Faworski-Babayan-Bedingungen zu 2-Methyl-3-butin-2-ol (2) ethinyliert wird, wird durch eine selektive Hydrierung an einem Lindlar-Katalysator 2-Methyl-3-buten-2-ol (3) hergestellt. Parallel wird ebenfalls aus Aceton durch eine säurekatalysierte Acetalisierung mit Methanol das Acetondimethylacetal (4) (2,2-Dimethoxypropan) erzeugt, welches pyrolytisch unter Abspaltung von einem Molekül Methanol zum Isopropenylmethylether (5) gespalten wird. Dieser reagiert zusammen mit dem zuvor erzeugten 2-Methyl-3-buten-2-ol unter saurer Katalyse (z. B. Phosphorsäure) bei 120–200 °C und 2–7 bar zu dem Allylvinylether (6).[7] Bei erhöhten Temperaturen geht dieser eine Claisen-Umlagerung, also eine [3.3]-sigmatrope Umlagerungsreaktion, ein. Diese verläuft über einen sechsgliedrigen Übergangszustand (7), wodurch das Endprodukt 6-Methyl-5-hepten-2-on (8) gebildet wird.[8][9]

Diketen-Acetessigester Route
[Bearbeiten | Quelltext bearbeiten]Eine weitere Route zur Herstellung von 6-Methyl-5-hepten-2-on geht ebenfalls von Aceton (1), welches analog zum Hoffmann-La Roche Prozess mit Acetylen zunächst zum 2-Methyl-3-butin-2-ol (2) und anschließend durch selektive katalytische Hydrierung an einem Lindlar-Katalysator zum 2-Methyl-3-buten-2-ol (3) umgesetzt wird. Durch Zugabe von Diketen (4) (alternativ Acetessigsäureethylester im Rahmen einer Umesterung) und einer Base (häufig Aluminiumtriisopropanolat) erfolgt die Umsetzung zum Allylacetoacetat (5). Beim Erhitzen geht dieses nach einer Keto-Enol-Tautomerie eine Carroll-Umlagerung ein (6), wobei im Zuge dessen aus dem Zwischenprodukt (7) relativ leicht Kohlendioxid abgespalten wird (Decarboxylierung) und 6-Methyl-5-hepten-2-on (8) gebildet wird.[9]

Rhône-Poulenc / Kuraray-Prozess
[Bearbeiten | Quelltext bearbeiten]Ein dritter Syntheseweg wurde von Rhône-Poulenc[10] und Kuraray[11] ausgearbeitet. Ausgehend von Isopren (1) erfolgt zunächst eine Hydrochlorierung (Addition von Chlorwasserstoff) zu einem Gemisch aus Prenylchlorid (1-Chlor-3-methyl-2-buten) (2) und etwas 3-Chlor-3-methyl-1-buten (3). Das Verhältnis der beiden Hydrochlorierungsprodukte kann durch die Wahl geeigneter Reaktionsbedingungen beeinflusst werden. Während 3-Chlor-3-methyl-1-buten bevorzugt nach einem 1,2-Additionsmechanismus entsteht, wird Prenylchlorid durch eine konjugierte 1,4-Addition gebildet. Durch Zugabe einer Base und eines Phasentransferkatalysators und Aceton (4) erfolgt im zweiten Schritt die nukleophile Substitutionsreaktion unter Bildung von 6-Methyl-5-hepten-2-on (5). Hierbei reagieren beide Hydrochlorierungsprodukte 2 und 3 mit dem Enolat des Acetons zum gleichen Endprodukt. Während die nukleophile Substitutionsreaktion von Prenylchlorid über einen SN2-Mechanismus abläuft, reagiert 3-Chlor-3-methyl-1-buten nach einem SN2'-Mechanismus.[8][9]

BASF-Prozess
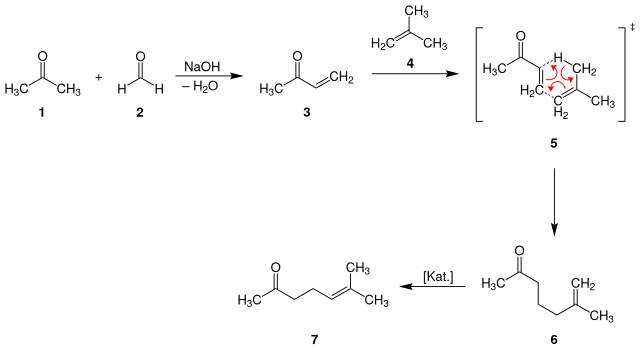
[Bearbeiten | Quelltext bearbeiten]Auch der von der BASF[12] entwickelte Prozess geht von Aceton (1) aus, welches zunächst unter basischen Bedingungen einer Aldolkondensation mit Formaldehyd (2) unterworfen wird. Das entstehende Methylvinylketon (3) reagiert anschließend mit Isobuten (4) in einer Carbonyl-En-Reaktion (5) zum isomeren 6-Methyl-6-hepten-2-on (6). Durch Isomerisierung an einem Palladium-Katalysator entsteht schließlich 6-Methyl-5-hepten-2-on (7).[8][13]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]6-Methyl-5-hepten-2-on hat einen starken, frisch zitrusartig-grünen Geruch und einen bittersüßen Geschmack, der an Birnen erinnert.[3]
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Verbindung hat eine relative Dichte des Dampf-Luft-Gemisches von 1,00 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Die dynamische Viskosität beträgt 0,98 mPa·s bei 20 °C.[2]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]6-Methyl-5-hepten-2-on ist eine entzündbare, jedoch schwer flüchtige Verbindung aus der Stoffgruppe der Ketone. Die Verbindung ist leichter als Wasser und darin nur schwer löslich. Wässrige Lösungen von 6-Methyl-5-hepten-2-on reagieren nur sehr schwach sauer. Eine Lösung mit 3 g·l−1 weist bei 25 °C einen pH-Wert von 6,6 auf.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]6-Methyl-5-hepten-2-on wird hauptsächlich als Zwischenprodukt bei der Herstellung von diversen Aromachemikalien wie Linalool und darauf aufbauenden Terpenoiden eingesetzt.[9] Die Verbindung wird aufgrund ihres angenehm fruchtigen Geruchs auch selbst als Aromastoff verwendet.[3]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Die Dämpfe von 6-Methyl-5-hepten-2-on können mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt explosive Gemische bilden. 6-Methyl-5-hepten-2-on wird hauptsächlich durch den Atemtrakt und die Haut aufgenommen. Bei Aufnahme oder Verschlucken kann es zu Reizwirkungen auf Schleimhäute und Haut kommen, wobei zur systemischen und chronischen Wirkungsweise bisher keine Angaben bekannt sind. Zur Reproduktionstoxizität, mutagene Wirkung und Kanzerogenität liegen bisher keine Angaben vor. 6-Methyl-5-hepten-2-on weist eine untere Explosionsgrenze (UEG) von 1,1 Vol.-% und eine obere Explosionsgrenze (OEG) von 7,3 Vol.-% auf. Mit einem Flammpunkt von 50 °C gilt 6-Methyl-5-hepten-2-on als entflammbar.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu 6-METHYL-5-HEPTEN-2-ONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. April 2023.
- ↑ a b c d e f g h i j k l m n o Eintrag zu 6-Methyl-5-hepten-2-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2023. (JavaScript erforderlich)
- ↑ a b c d e George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. 6. Auflage. CRC Press, 2010, ISBN 978-1-4200-9086-4, S. 1283.
- ↑ Eintrag zu 6-methylhept-5-en-2-one im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 31. März 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Sandrine Mathieu, Valeriano Dal Cin, Zhangjun Fei, Hua Li, Peter Bliss, Mark G. Taylor, Harry J. Klee, Denise M. Tieman: Flavour compounds in tomato fruits: identification of loci and potential pathways affecting volatile composition. In: Journal of Experimental Botany. Band 60, 2008, S. 325–337, doi:10.1093/jxb/ern294.
- ↑ Rainer Radtke: Die Kleptoparasitische Neotropische Biene Lestrimelitta limao Verhalten und chemische Kommunikation bei Raubzügen auf Nester anderer stachelloser Bienen. diplom.de, 1997, ISBN 3-8324-0545-3, S. 88 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patent CH416596A: Verfahren zur Herstellung von ungesättigten Carbonylverbindungen. Veröffentlicht am 15. Juli 1966, Anmelder: F. Hoffmann-La Roche & Co. Aktiengesellschaft, Erfinder: Roman Marbet, Gabriel Saucy.
- ↑ a b c Charles S. Sell: Terpenoids. In: Kirk‐Othmer Encyclopedia of Chemical Technology. Wiley-VCH, 15. September 2006, doi:10.1002/0471238961.2005181602120504.a01.pub2.
- ↑ a b c d Horst Surburg, Johannes Panten (Hrsg.): Common Fragrance and Flavor Materials: Preparation, Properties and Uses. Wiley-VCH, 2016, doi:10.1002/9783527693153.
- ↑ Patent FR1384137A: Nouveau procédé d'alcoylation de cétones et produits obtenus. Veröffentlicht am 4. Januar 1965, Anmelder: Rhône-Poulenc.
- ↑ Patent US3983175A: Process for the production of a substituted ketone. Veröffentlicht am 28. September 1976, Anmelder: Kuraray Co., Erfinder: Yoshin Tamai, Takashi Nishida, Fumio Mori, Yoshiaka Omura, Masahisa Tanomura, Takeo Hosogai, Yoichi Ninagawa, Kazuo Itoi.
- ↑ Patent DE1618098B1: Verfahren zur Herstellung von Alkenolen und von Alkenonen. Veröffentlicht am 14. Oktober 1971, Anmelder: BASF AG, Erfinder: Herbert Müller, Hermann Overwien, Horst Pommer.
- ↑ Patent US3670028A: PRODUCTION OF 2-METHYL-2-HEPTEN-6-ONE. Veröffentlicht am 13. Juni 1972, Anmelder: BASF AG, Erfinder: Herbert Mueller, Harald Koehl, Horst Pommer.




