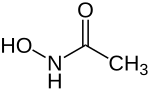
Acetohydroxamsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Acetohydroxamsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H5NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 75,07·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
89–92 °C[2] | |||||||||||||||||||||
| pKS-Wert |
8,70[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Acetohydroxamsäure (abgekürzt AHA) ist ein Arzneistoff, der in der Behandlung von Harnwegsinfektionen durch bestimmte Erreger eingesetzt wird. Der Wirkstoff aus der Gruppe der Enzyminhibitoren hemmt potent und irreversibel das Enzym Urease, das von verschiedenen Bakterien und Pflanzen gebildet wird. Das Molekül ähnelt chemisch dem Harnstoff, ist aber nicht durch Urease hydrolysierbar.[4] AHA stört somit den Stoffwechsel der Bakterien durch kompetitive Hemmung.
Therapeutische Verwendung
[Bearbeiten | Quelltext bearbeiten]Die US Food and Drug Administration (FDA) erteilte Acetohydroxamsäure 1983 eine Zulassung als Orphan-Arzneimittel (Arzneimittel für seltene Leiden) zur Vorbeugung von sogenannten „Struvitsteinen“ unter dem seinerzeit neu geschaffenen Orphan Drug Act von 1983.[5] AHA konnte nicht patentiert werden, da es sich um eine chemische Standardverbindung handelt.[5]
Struvitsteine (Magnesiumammoniumphosphatsteine, Infektsteine) machen 10 bis 15 % der Nierensteinerkrankungen (Urolithiasis) beim Menschen aus. Sie treten auf bei Patienten mit chronischen Harnwegsinfektionen, die durch ureaseproduzierende Erreger – am häufigsten Proteus mirabilis, weniger häufig Klebsiella pneumoniae, Pseudomonas aeruginosa und Enterobacter – verursacht werden. Die Urease spaltet den im Urin enthaltenen Harnstoff zu Ammoniak und Kohlenstoffdioxid, wodurch der Urin-pH-Wert erhöht wird. Unter diesen Bedingungen entstehen unlösliche Salze, die sich in den harnableitenden Wegen ablagern. Es resultieren starke Schmerzen bis hin zur Nierenkolik, Hämaturie (blutiger Urin), Blockade des Urinflusses (obstruktiver Uropathie) und Hydronephrose (Erweiterung der Niere). Frauen sind eher betroffen als Männer.[6]
Die Behandlung erfolgt adjuvant und ersetzt nicht antimikrobielle oder chirurgische Maßnahmen.[7] Ureasehemmer zeigen nur einen beschränkten Nutzen für die Behandlung von Struvitsteinen.[8]
Wirkungsmechanismus
[Bearbeiten | Quelltext bearbeiten]Acetohydroxamsäure (AHA) ist ein Urease-Inhibitor: mittels der Hemmung des bakteriellen Enzyms Urease unterdrückt sie die Hydrolyse von Harnstoff und somit die Bildung von Ammoniak im Urin. Der reduzierte Ammoniakgehalt und der verringerte pH-Wert erhöhen die Wirksamkeit antimikrobieller Wirkstoffe und ermöglichen eine verbesserte Heilungsrate dieser Infektionen. AHA säuert den Urin weder direkt an noch hat es eine direkte antibakterielle Wirkung.[7]

Unerwünschte Wirkungen und Anwendungsbeschränkungen
[Bearbeiten | Quelltext bearbeiten]Phlebitis, Thromboembolie, hämolytische Anämie und Eisenmangelanämie können als Nebenwirkung auftreten; ferner Kopfschmerzen, Magen-Darm-Störungen, Haarausfall, Hautausschlag, Angstzustände, Nervosität und Zittern. In Studien führten die psychiatrischen Nebenwirkungen bei etwa 6 % der Patienten zu einer Unterbrechung oder einem Abbruch der Behandlung.[7]
In Tierstudien traten teratogene Wirkungen auf. Es gibt Hinweise auf ein Risiko für den menschlichen Fötus, so dass die Anwendung in der Schwangerschaft kontraindiziert ist. Auch bei eingeschränkter Nierenfunktion darf AHA nicht zur Anwendung kommen.[7]
Der Metabolit Acetamid erzeugte bei Ratten (in 80-facher maximaler Humandosis) Leberkrebs. In vitro (an in Kulturen gezüchteten Zellen) zeigte sich AHA genotoxisch.[7]
Das ungünstige Nebenwirkungsprofil schränkt den klinischen Einsatz von AHA ein.[8]
Handelspräparate
[Bearbeiten | Quelltext bearbeiten]Lithostat (USA), Uronefrex (ES)
See also
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Acetohydroxamsäure bei Sigma-Aldrich, abgerufen am 4. März 2022 (PDF).
- ↑ Acetohydroxamic acid. CAS Common Chemistry, abgerufen am 3. März 2022 (englisch).
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ W. N. Fishbein, P. P. Carbone: Urease Catalysis. II. Inhibition of the Enzyme by Hydroxyurea, Hydroxylamine, and Acetohydroxamic Acid. In: The Journal of Biological Chemistry. Band 240, Juni 1965, S. 2407–2414, PMID 14304845.
- ↑ a b C. Marwick: New drugs selectively inhibit kidney stone formation. In: JAMA. Band 250, Nr. 3, 15. Juli 1983, S. 321–2, doi:10.1001/jama.1983.03340030003001, PMID 6854890.
- ↑ T. Alelign, B. Petros: Kidney Stone Disease: An Update on Current Concepts. In: Advances in Urology. 2018, doi:10.1155/2018/3068365.
- ↑ a b c d e LABEL: LITHOSTAT- acetohydroxamic acid tablet, DailyMed, abgerufen am 6. März 2022.
- ↑ a b R. Flannigan, W. H. Choy, B. Chew, D. Lange: Renal struvite stones—pathogenesis, microbiology and management strategies. In: Nature Reviews Urology. Bd. 11, Nr. 6, 2014, S. 333–341. doi:10.1038/nrurol.2014.99.
