Chelidonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chelidonsäure | ||||||||||||||||||
| Andere Namen |
4-Oxo-4H-pyran-2,6-dicarbonsäure (IUPAC) | ||||||||||||||||||
| Summenformel | C7H4O6 | ||||||||||||||||||
| Kurzbeschreibung |
hellrotes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 184,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
mäßig in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Chelidonsäure ist eine heterocyclische organische Dicarbonsäure. Sie besitzt ein Pyran-Grundgerüst.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Bei der Untersuchung des Krauts und der Wurzel des Schöllkrauts entdeckte J. M. A. Probst 1839 die Chelidonsäure. Lerch (1846), Hutstein (1851) und Wilde (1863) veröffentlichten in der Folge die Ergebnisse ihrer Forschungen.[3][4][5][6][7]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur Herstellung von Chelidonsäure wird zunächst Aceton in einer zweifachen Claisen-Kondensation mit Oxalsäurediethylester umgesetzt. Als Base wird praktischerweise Natriumethanolat verwendet. Der hierbei entstehende 2,4,6-Trioxo-1,7-dicarbonsäurediethylester kann anschließend mittels wässriger Salzsäure zu Chelidonsäure cyclisiert werden.[8]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chelidonsäure ist ein farbloser und geruchloser Feststoff, der bei 265 °C schmilzt. Sie löst sich schlecht in Wasser.[9]
Reaktionen
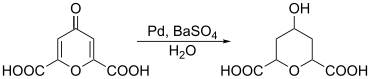
[Bearbeiten | Quelltext bearbeiten]Durch Reduktion kann Chelidonsäure zur Herstellung von 2,6-Pyrandicarbonsäuren genutzt werden. Zur Reduktion kann beispielsweise ein Palladiumkatalysator herangezogen werden.[10]
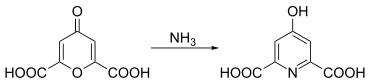
Chelidonsäure reagiert mit Aminen zu Hydropyridindicarbonsäure-Derivaten. So kann Chelidamsäure durch die Umsetzung mit Ammoniak aus Chelidonsäure gewonnen werden.
Werden an Stelle von Ammoniak primäre Amine (z. B. Ethylamin) verwendet, können N-alkylierte Pyridinderivate erhalten werden:[11]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Chelidonic acid bei Sigma-Aldrich, abgerufen am 7. Februar 2019 (PDF).
- ↑ Frank Humphreys Storer: First Outlines of a Dictionary of Solubilities of Chemical Substances. Sever and Francis, 1864, S. 125 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dr. Probst. Beschreibung und Darstellungsweise einiger bei der Analyse des Chelidonium majus neu aufgefundenen Stoffe. In: Annalen der Pharmacie, Band XXIX (1839), S. 116–120: Chelidonsäure (Digitalisat)
- ↑ Joseph Udo Lerch (1816–1892). Untersuchung der Chelidonsäure. In: Annalen der Chemie und Pharmacie, Band LVII (1846), S. 273–318 (Digitalisat)
- ↑ J. Hutstein in Breslau. Darstellung der Chelidonsäure. In: Archiv der Pharmacie. Zweite Reihe Band LXV (1851), S. 23–24 (Digitalisat)
- ↑ C. Wilde. Über Chelidonsäure. In: Annalen der Chemie und Pharmacie, Band CXXVII (1863), 2. Heft S. 164–170 (Digitalisat)
- ↑ August Husemann und Theodor Husemann: Die Pflanzenstoffe in chemischer, physiologischer, pharmakologischer und toxikologischer Hinsicht. Für Aerzte, Apotheker, Chemiker und Pharmakologen. Springer, Berlin 1871, S. 782-–786: Chelidonsäure. Chelidonimsäure. Chelidoxanthin. (Digitalisat)
- ↑ G. Horvath, C. Russa, Z. Koentoes, J. Gerencser, Synth. Comm., 1999, 29, 21, S. 3719–3732.
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 446 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Attenburrow, J. Chem. Soc., 1945, S. 571–574.
- ↑ D. G. Markees, J. Org. Chem., 1958, 23, S. 1030, doi:10.1021/jo01101a025.
