Dianhydrohexitole
Dianhydrohexitole (Isohexide) sind aus zwei anellierten Tetrahydrofuran-Ringen gebildete bicyclische sauerstoffhaltige Heterocyclen, die durch zweifache Dehydratisierung aus den Zuckeralkoholen Sorbit (auch als Sorbitol oder Glucitol bezeichnet), Mannit (Mannitol) oder Iditol entstehen. Isohexide, insbesondere Isosorbid, sind zukunftsträchtige Dialkohole aus biogenen Rohstoffen und finden Verwendung als Präkursoren für Lösungsmittel und Arzneistoffe gegen Angina Pectoris, sowie als Bausteine für biobasierte und bioabbaubare Polymere, wie z. B. Poly(isosorbidsuccinat) PIS.[1][2]
Strukturen
[Bearbeiten | Quelltext bearbeiten]Dianhydrohexitole sind optisch aktive sekundäre Diole und zeigen endo-exo-Isomerie.
| Isosorbid | Isoidid | Isomannid |
 |
 |

|
|---|---|---|
| 1,4:3,6-dianhydro-D-glucidol | 1,4:3,6-dianhydro-L-iditol | 1,4:3,6-dianhydro-D-mannitol |
Das Vorliegen von 1,4:3,6-anellierten Ringen in allen drei epimeren Isohexiden wurde in den 1940er Jahren geklärt.[3][4]
Die Hydroxygruppe in 2-Stellung von Isosorbid (1,4:3,6-Dianhydro-D-glucidol oder 1,4:3,6-Dianhydro-D-sorbitol) liegt in exo-Konfiguration vor, während die 5-Position endo-konfiguriert ist. In Isoidid (1,4:3,6-Dianhydro-L-iditol) sind beide OH-Gruppen exo-exo, in Isomannid (1,4:3,6-Dianhydro-D-mannitol) endo-endo orientiert sind.[5][6]
Im Isomannid bilden die beiden endo-ständigen Hydroxygruppen intramolekulare Wasserstoffbrücken,[7] während im Isosorbid nur die endo-OH-Gruppe in 5-Stellung zur intramolekularen Wasserstoffbindung befähigt ist.

Die in einem Winkel von 120° cis- bzw. V-förmige Anordnung des bicyclischen Systems der 1,4:3,6-Dianhydrohexitole bedingt eine unterschiedliche sterische Beeinflussung der Hydroxygruppen und damit auch eine verschiedene Reaktivität. Während die endo-OH-Gruppe im Isosorbid durch die intramolekulare Wasserstoffbrücke aktiviert ist und dadurch eine höhere Nukleophilie und Reaktivität besitzt, ist die exo-ständige OH-Gruppe für sterisch anspruchsvolle Substituenten einfacher zugänglich.
Vorkommen und Darstellung
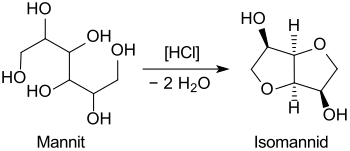
[Bearbeiten | Quelltext bearbeiten]Bei 24-stündigem Erhitzen von Mannit mit Salzsäure wurde 1884 erstmals Isomannid erhalten.[8]
Die Vorstufe Sorbit für Isosorbid[9] wird durch Hydrierung von D-Glucose – aus Stärke oder Biomasse, wie Cellulose – inzwischen in Megatonnenmengen hergestellt.
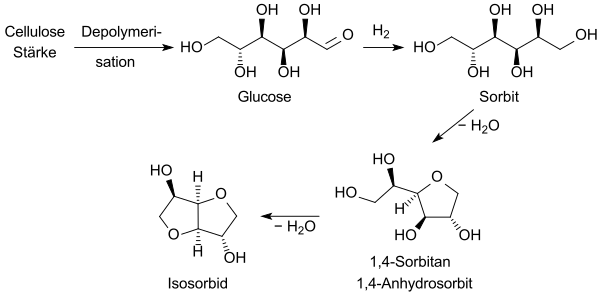
und säurekatalysiert zu Isosorbid dehydratisiert. Der Prozess wurde erstmals 1927 in einem Patent beschrieben.[10]
Die Synthese von Isomannid erfordert einen zusätzlichen Schritt zum primären Ausgangsstoff D-Fructose entweder durch Isomerisierung von Glucose oder durch Spaltung von Saccharose. Fructose wird durch katalytische Hydrierung,[11] bzw. biotechnologisch mit Milchsäurebakterien,[12] in Mannit überführt. Aus dem Alditol Mannit wird z. B. mittels Dehydratisierung mit festen Säuren (sauren Zeolithen) in Ausbeuten bis 63 % das Dianhydrohexitol Isomannid erhalten.[13]
Neuerdings wurde die Dehydratisierung von Sorbit und Mannit mit Dimethylcarbonat als wasserentziehendes Mittel unter Katalyse mit starken Stickstoffbasen, wie z. B. Diazabicycloundecen DBU zu Isosorbid bzw. Isomannid beschrieben.[14]
Vorstufe für das dritte Isohexid, Isoidid, ist die nicht natürliche Aldose L-Idose bzw. der daraus abgeleitete Zuckeralkohol L-Iditol. Daher muss Isoidid auf dem Umweg der Isomerisierung von Isomannid und Isosorbid gewonnen werden.[15]
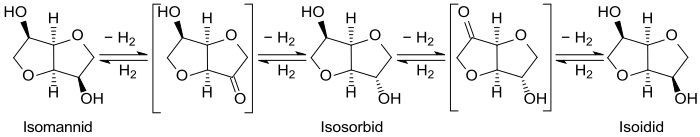
Bei Temperaturen über 200 °C und Wasserstoffdrücken von 100–250 bar in der Gegenwart von Raney-Nickel stellt sich – wahrscheinlich über einen Dehydrierungs/Hydrierungsmechanismus[16] – ein Gleichgewichtsgemisch der beispielhaften Zusammensetzung 55:45:5 für Isoidid, Isosorbid und Isomannid ein, das z. B. destillativ[17] in die einzelnen Isohexide zerlegt werden kann.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die unterschiedliche Anordnung der beiden Hydroxygruppen der Dianhydrohexitole bedingt Unterschiede in den physikalischen Eigenschaften, wie Schmelzpunkten und Dipolmomenten bzw. Polaritäten[16] oder Verteilungsverhalten zwischen mobiler und stationärer Phase in der Dünnschichtchromatographie, sowie in den chemischen Eigenschaften, wie z. B. Reaktivitäten
| Dianhydrohexitole | Schmelzpunkt °C[15] | Dipolmoment D[16] | Rf-Wert (Kieselgel, EtOH)[5] |
|---|---|---|---|
| Isomannid | 86,7–89,5 | 3.17 | 0,42 |
| Isosorbid | 61,9–64,0 | 1.65 | 0,52 |
| Isoidid | 63,7–64,5 | 1.91 | 0,60 |
So ist die endo-ständige Hydroxygruppe (in 5-Position) im Isosorbid reaktiver, aber die exo-ständige Hydroxygruppe (in 2-Stellung) für sperrige Reaktanden leichter angreifbar. Die endo-ständigen sekundären Hydroxygruppen lassen sich auch leicht zu Ketonen mit Platin als Katalysator oxidieren, wobei mit Isomannid das 2,5-Diketon und mit Isosorbid das 5-Monoketon entsteht, während unter diesen Bedingungen Isoidid nicht angegriffen wird.[5]

Isoidid lässt sich wie Isosorbid und Isomannid durch Umkristallisieren aus Ethylacetat reinigen und ist im Gegensatz zu den beiden anderen Isohexiden in Chloroform nur wenig löslich.[4] Der Geschmack von Isosorbid und Isomannid wird als süß mit einer Spur von Bitterkeit beschrieben.[18]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Isosorbid ist aufgrund seiner verhältnismäßig einfachen synthetischen Zugänglichkeit inzwischen auch in industriellem Maßstab verfügbar – z. B. betreibt das Unternehmen Roquette Frères in Lestem, Frankreich seit 2015 eine Anlage mit einer Jahreskapazität von 20,000 Tonnen.[19]
Isomannid und besonders Isoidid haben wegen ihrer eingeschränkten Verfügbarkeit, ihres hohen Preises und – im Fall von Isomannid – geringeren Aktivität in Polymerisationsreaktionen[20] bisher bei weitem nicht die Bedeutung von Isosorbid erlangt.
Das zur Plattformchemikalie aus nachwachsenden Rohstoffen erklärte Isosorbid[9] findet in Form des Isosorbidmononitrats und Isosorbiddinitrats Verwendung als Wirkstoff gegen Angina Pectoris und als Rohstoff für Polymere aus nachwachsenden Rohstoffen, wie z. B. als Diolkomponente für Polyurethane und Epoxidharzee, als Ersatz für Bisphenol A in Polycarbonaten und als Comonomer in Polyestern wie Poly(ethylen-co-isosorbid)terephthalat PEIT[21]. Isosorbiddiester mit langkettigen (C8 und C12) Carbonsäuren werden als Weichmacher für Polyvinylchlorid PVC vorgeschlagen.[22]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ D. Braun, M. Bergmann: 1,4:3,6-Dianhydrohexite als Bausteine für Polymere. In: Adv. Synth. Catal. Band 334, Nr. 4, 1992, S. 298–310, doi:10.1002/prac.19923340403.
- ↑ M. Lomeli-Rodriguez, J.R. Corpas-Martinez, S. Willis, R. Mulholland, J.A. Lopez-Sanchez: Synthesis and characterization of renewable polyester coil coatings from biomass-derived isosorbide, FDCA, 1,5-pentanediol, succinic acid, and 1,3-propanediol. In: Polymers. Band 10, Nr. 6, 2018, S. 600, doi:10.3390/polym10060600.
- ↑ R. Montgomery, L.F. Wiggins: 77. The anhydrides of polyhydric alcohols. Part IV. The constitution of dianhydro sorbitol. In: J. Chem. Soc. 1946, S. 390–393, doi:10.1039/JR460000390.
- ↑ a b H.G. Fletcher, Jr., R.M. Goepp, Jr.: Hexitol anhydrides. 1,4,3,6-dianhydro-L-iditol and the structures of isomannide and isosorbide. In: J. Amer. Chem. Soc. Band 68, Nr. 6, 1946, S. 939–941, doi:10.1021/ja01210a007.
- ↑ a b c K. Heyns, W.-P. Trautwein, H. Paulsen: Über katalytische Oxidationen, XX. Selektive katalytische Oxidation von 1.4;3.6-Dianhydro-hexiten. In: Chem. Ber. Band 96, Nr. 12, 1963, S. 3195–3199, doi:10.1002/cber.19630961214.
- ↑ G. Flèche, M. Huchette: Isosorbide. Preparation, Properties and Chemistry. In: Starch. Band 38, Nr. 1, 1986, S. 26–30, doi:10.1002/star.19860380107.
- ↑ A.C. Cope, T.Y. Shen: The stereochemistry of 1,4:3,6-dianhydrohexitol derivatives. In: J. Amer. Chem. Soc. Band 78, Nr. 13, 1956, S. 3177–3182, doi:10.1021/ja01594a055.
- ↑ A. Fauconnier: Anhydride de la mannite. In: Bull. Soc. Chim. France. Band 2, Nr. 41, 1884, S. 119–125 (bnf.fr).
- ↑ a b M. Rose, R. Palkovits: Isosorbide as a renewable platform chemical for versatile applications – quo vadis? In: ChemSusChem. Band 5, Nr. 1, 2012, S. 167–176, doi:10.1002/cssc.201100580.
- ↑ Patent DE488602: Verfahren zur Herstellung wertvoller Produkte aus Sorbit. Angemeldet am 8. Juni 1927, veröffentlicht am 12. Dezember 1929, Anmelder: I.G. Farbenindustrie AG, Erfinder: J. Müller, U. Hoffmann.
- ↑ B. Toukoniitty, J. Kuusisto, J.-P. Mikkola, T. Salmi, D.Y. Murzin: Effect of ultrasound on catalytic hydrogenation of D-Fructose to D-Mannitol. In: Ind. Eng. Chem. Res. Band 44, Nr. 25, 2005, S. 9370–9375, doi:10.1021/ie050190s.
- ↑ S.H. Song, C. Vielle: Recent advances in the biological production of mannitol. In: Appl. Microbiol. Biotechnol. Band 84, Nr. 1, 2009, S. 55–62, doi:10.1007/s00253-009-2086-5.
- ↑ H. Yokoyama, H. Kobayashi, J. Hasegawa, A. Fukuoka: Selective dehydration of mannitol to isomannide over Hβ zeolite. In: ACS Catal. Band 7, Nr. 7, 2017, S. 4828–4834, doi:10.1021/acscatal.7b01295.
- ↑ F. Aricò, S. Evaristo, P. Tundo: Synthesis of five- and six-membered heterocycles by dimethyl carbonate with catalytic amounts of nitrogen bases. In: Green Chem. Band 17, Nr. 2, 2015, S. 1176–1185, doi:10.1039/C4GC01822B.
- ↑ a b H.G. Fletcher, R.M. Goepp: 1,4:3,6-Hexitol dianhydride L-Isoidide. In: J. Amer. Chem. Soc. Band 67, Nr. 6, 1945, S. 1042–1043, doi:10.1021/ja01222a513.
- ↑ a b c Rebecca V. Engel: Heterogeneously catalysed amination and isomerisation of isohexides. Hrsg.: RWTH Aachen, Dissertation. Aachen 2016 (rwth-aachen.de).
- ↑ Patent EP2817314B1: Method of making isoidide. Angemeldet am 19. Februar 2013, veröffentlicht am 19. April 2017, Anmelder: Stichting Wageningen Research, Archer-Daniels-Midland Co., Erfinder: E. Hagberg, K. Martin, J.H. van Ee, J.E.L. Le Nôtre, D.S. van Es, J. van Haveren.
- ↑ C.K. Lee, G.G. Birch: Structural functions of taste in the sugar series: gustatory properties of anhydro sugars. In: J. Food Sci. Band 40, Nr. 4, 1975, S. 784–787, doi:10.1111/j.1365-2621.1975.tb00556.
- ↑ N.N.: Roquette launches ‚world’s largest‘ isosorbide production unit. In: Additives for Polymers. Band 2015, Nr. 6, 2015, S. 8–9, doi:10.1016/S0306-3747(15)30073-7.
- ↑ F. Fenouillot, A. Rousseau, G. Colomines, R. Saint-Loup, J.-P. Pascault: Polymers from renewable 1,4:3,6-dianhydrohexitols (isosorbide, isomannide and isoidide): a review. In: Progress Polym. Sci. Band 35, Nr. 5, 2010, S. 578–622, doi:10.1016/progpolymsci.2009.10.001.
- ↑ J.C. Bersot, N. Jacquel, R. Saint-Loup, P. Fuertes: Efficiency increase of poly(ethylene terephthalate-co-isosorbide terephthalate) synthesis using bimetallic catalytic systems. In: Macromol. Chem. Phys. Band 212, Nr. 19, 2011, S. 2114–2120, doi:10.1002/macp.201100146.
- ↑ Y. Yang, J. Huang, R. Zhang, J. Zhu: Designing bio-based plasticizers: Effect of alkyl chain length on plasticization properties of isosorbide diesters in PVC blends. In: Mater. Design. Band 126, 2017, S. 29–36, doi:10.1016/j.matdes.2017.04.005.