Galliumhydroxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Ga3+ _ OH− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Galliumhydroxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Ga(OH)3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,74 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,84 g·cm−3[3] | |||||||||||||||
| Löslichkeit |
löslich in verdünnten Mineralsäuren[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Galliumhydroxid ist eine chemische Verbindung des Galliums aus der Gruppe der Hydroxide.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Galliumhydroxid kommt natürlich als Mineral Söhngeit vor.[6]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Galliumhydroxid entsteht bei der Neutralisation von Gallium(III)-Salz-Lösungen.[1] Galliumhydroxid-Hydrat fällt als Kuppelprodukt der Aluminiumgewinnung an.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Galliumhydroxid kommt entweder als farblose amorphe Masse[1] oder als farblose orthorhombische und pseudokubische kristalline Substanz vor.[2] Neben dem Galliumhydroxid kann auch Gallium(III)-oxid-monohydrat (GaO(OH) oder Ga2O3 • H2O) als weiteres Hydroxid des Galliums (Galliumoxidhydroxid) aufgefasst werden[1], welches beim längeren Erhitzen von Galliumhydroxid bei etwa 170 °C[4], durch Erhitzen auf 900 °C bei 50 kbar unter hydrothermalen Bedingungen oder langsam durch Alterung entsteht. Bei Erhitzung über 500 °C zersetzt es sich unter Bildung von Gallium(III)-oxid.[7]
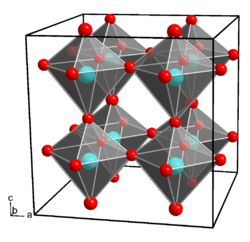
Galliumhydroxid kristallisiert im orthorhombischen Kristallsystem, Raumgruppe Pmn21 (Raumgruppen-Nr. 31), mit den Gitterparametern a = 7,487 Å, b = 7,438 Å und c = 7,496 Å.[8] Jedes Galliumatom wird dabei von sechs Hydroxidionen oktaedrisch koordiniert, jede Hydroxidion bindet an zwei Galliumionen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion mit Schwefelwasserstoff kann Gallium(III)-sulfid gewonnen werden.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Kirk-Othmer Encyclopedia of Chemical Technology: Gallium and Gallium Compounds ( vom 27. April 2012 im Internet Archive)
- ↑ a b Handbookofmineralogy: Söhngeit (PDF; 70 kB)
- ↑ Jean D’Ans, Ellen Lax; Taschenbuch für Chemiker und Physiker: Band 3, S. 464; ISBN 978-3-540-60035-0
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 855.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Gallium trihydroxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Mai 2020.
- ↑ Mineralienatlas:Söhngeit
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1196.
- ↑ J.D. Scott: Crystal structure of a new mineral, sohngeite. In: American Mineralogist, 56, 1871, S. 355.
- ↑ Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 857.


