Natriumiodat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
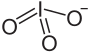
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumiodat | ||||||||||||||||||
| Andere Namen |
iodsaures Natrium | ||||||||||||||||||
| Summenformel | NaIO3 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,89 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,28 g·cm−3[1] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser (94,7 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Natriumiodat ist eine chemische Verbindung (genauer das Natriumsalz der Iodsäure) aus der Gruppe der Iodate. Es ist ein licht-, luft- und feuchtigkeitsempfindlicher, farb- und geruchloser Feststoff.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Natürlich kommt Natriumiodat in einigen Mineralien und Verbindungen z. B. als Beimengung in Chilesalpeter vor.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natriumiodat kann durch Reaktion einer Natrium enthaltenden Base wie zum Beispiel Natriumhydroxid mit Iodsäure hergestellt werden:
Weiterhin ist die Darstellung durch Reaktion von Iod mit einer heißen Natriumhydroxidlösung möglich:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Natriumiodat ist ein Oxidationsmittel. Es kristallisiert im orthorhombischen Kristallsystem mit den Gitterparametern a = 5,75 Å, b = 6,37 Å und c = 4,05 Å.[4] Von der Verbindung sind ein Monohydrat und ein Pentahydrat bekannt.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Natriumiodat wird als Konservierungsmittel in der Lebensmittelindustrie und als Zusatzstoff in iodiertem Speisesalz eingesetzt.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Kaliumiodat
- Natriumperiodat NaIO4
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Sodium iodate, ≥99% bei Sigma-Aldrich, abgerufen am 29. Januar 2017 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-90.
- ↑ a b Eintrag zu Natriumiodat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Februar 2024. (JavaScript erforderlich)
- ↑ I. Náray-Szabó, J. Neugebauer: The Crystal Structure of Sodium Iodate. In: J. Am. Chem. Soc. 1947, 69 (6), S. 1280–1283. doi:10.1021/ja01198a016.
- ↑ H. Miyamoto, M. Salomon: Alkali Metal Halates, Ammonium Iodate & Iodic Acid Solubility Data Series. Elsevier, 2013, ISBN 978-1-4832-8606-8, S. 330 (eingeschränkte Vorschau in der Google-Buchsuche).



