Phyllochinon
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin K1 | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C31H46O2 | ||||||||
| CAS-Nummer | 84-80-0 | ||||||||
| ATC-Code | |||||||||
| Kurzbeschreibung | gelbe bis grüne, klare, viskose Flüssigkeit[1] | ||||||||
| Vorkommen | Kohl, Spinat, Rosenkohl, Kohlsprossen | ||||||||
| Physiologie | |||||||||
| Funktion | Blutgerinnung, Knochenstoffwechsel, Photosynthese, Vitamin-K-Zyklus | ||||||||
| Täglicher Bedarf | etwa 80 µg | ||||||||
| Folgen bei Mangel | Verlangsamung der Blutgerinnung, bei Säuglingen Hirnblutungen, Verdauungsstörungen | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 450,71 g·mol−1 | ||||||||
| Aggregatzustand | flüssig[1] | ||||||||
| Dichte | 0,984 g·cm−3 (20 °C)[1] | ||||||||
| Schmelzpunkt |
−20 °C[1] | ||||||||
| Löslichkeit | fettlöslich, auch in Ethanol, Benzol, Chloroform, Ether löslich | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Phyllochinon oder Vitamin K1 gehört zu den fettlöslichen K-Vitaminen. Im menschlichen Organismus spielt es unter anderem bei der Blutgerinnung eine wichtige Rolle. Zusammen mit Vitamin K2 zählt es als Vitamer zu den K-Vitaminen.
Es kommt vor allem in den Chloroplasten von Grünpflanzen vor, aber auch in Grünalgen und manchen Cyanobakterien.[2] Als normaler Bestandteil des Photosyntheseapparates und zum Teil in den Früchten tritt es in unterschiedlichen Konzentrationen auf. Bei der Photosynthese der Pflanzen ist es in der Elektronenübertragungskette im Photosystem I beteiligt.[3]
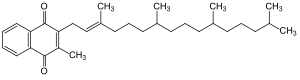
Das Molekül besteht aus einem Methylnaphthochinon (Menadion) mit einer Phytylseitenkette. Bei Raumtemperatur stellt es eine viskose Flüssigkeit dar.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Entdeckung des Vitamin K geht auf die Arbeiten des dänischen Forschers Henrik Dam zurück. Im Jahre 1943 erhielten er und Edward Adelbert Doisy – für die Aufdeckung der chemischen Natur des Vitamins K – den gemeinsamen Nobelpreis für Medizin. Die künstliche Synthese von Vitamin K1 gelang erstmals Louis Frederick Fieser im Jahr 1939.
Namen
[Bearbeiten | Quelltext bearbeiten]Vitamin K1 ist die triviale Bezeichnung für 2-Methyl-3-phytyl-1,4-naphthochinon (auch α-Phyllochinon). Seinen Ursprung hat der Name Phyllochinon von dem Wort Phyllos, das Blatt. Der Buchstabe K wurde eingesetzt, nach dem der dänische Forscher Henrik Dam um 1935 aus getrockneten Luzerne-Blättern eine fettlösliche Substanz isolierte, die eine ausgleichende Wirkung auf die Blutgerinnung zeigte (Koagulations-Vitamin) und man es der Einfachheit halber dann Vitamin K nannte. Es ist ein Terpenoid.
Beschreibung
[Bearbeiten | Quelltext bearbeiten]Nur mit der Hilfe von Gallensäure kann Vitamin K resorbiert werden. Die Resorption ist bei gleichzeitiger Aufnahme von Fetten gesteigert. Vitamin K ist in der Leber an der Herstellung verschiedener Blutgerinnungsfaktoren beteiligt. Weiterhin ist Vitamin K über körpereigene Proteine, beispielsweise Osteocalcin und über Funktionen innerhalb des Calciumstoffwechsels direkt am Knochenaufbau beteiligt. Aufgrund der Hitzestabilität der Vitamin-K-Gruppe treten beim Zubereiten, insbesondere beim Garen nur geringe Vitaminverluste auf. Vitamin K ist auch gegenüber Sauerstoff stabil. Unter Einstrahlung von Licht wird Vitamin K inaktiv und verliert schnell seine Bioverfügbarkeit.
Voraussetzungen für die Vitamin-K-Aktivität sind neben dem unsubstituierten, aromatischen Ring eine lipophile Seitenkette in trans-Konfiguration. Optimal sind natürliche Terpenketten mit 20 Kohlenstoffatomen. Seitenketten unter acht Kohlenstoffatomen führen außer bei Menadion zur Inaktivität.
Aufgabe/Funktion
[Bearbeiten | Quelltext bearbeiten]Blutgerinnung
[Bearbeiten | Quelltext bearbeiten]Die Hauptfunktion von Vitamin K besteht darin, dass es für die Synthese bestimmter Proteine (Prothrombin) notwendig ist, die in der Blutgerinnung eine wichtige Rolle einnehmen.[4][5] Mit diesen Faktoren werden Blutungen gestoppt (Gerinnung). Auch bei der Biosynthese von Proteinen im Knochen, in der Niere, im Plasma und Bindegewebe spielt Vitamin K eine große Rolle. Vitamin K1 ist als fettlösliches Vitamin an die Resorption der Fette gebunden. Die Resorptionsrate beträgt 60–80 Prozent. Vitamin K2 gelangt dagegen durch Diffusion in das Darmgewebe. Die Vitamine K1 und K2 gelangen über das Blut zum Knochenmark, zur Leber und Niere. Hier kann eine Speicherung bis zu 14 Tagen erfolgen. Ausgeschieden werden die Vitamine über die Galle und teilweise über die Nieren.
Die biologische Aktivität von Vitamin K ist auf seine Fähigkeit zurückzuführen, zwischen seinen oxidierten (Chinon) und reduzierten (Hydrochinon) Formen im Vitamin-K-Zyklus zu wechseln. Die wesentliche Bedeutung von Vitamin K liegt in seinem Beitrag zur posttranslationalen Einführung einer Carboxygruppe in die γ-Position von Glutamylresten spezifischer Proteine, wodurch sich deren Eigenschaften ändern. Seine wichtigste Funktion ist die Beteiligung an der Synthese verschiedener Blutgerinnungsfaktoren (Faktor X, IX, VII, II[6]).
Photosynthese
[Bearbeiten | Quelltext bearbeiten]Phyllochinon ist im Photosynthese-Reaktionszentrum Photosystem I enthalten, wo es in der Elektronenübertragungskette als sekundärer Elektronenakzeptor beteiligt ist.[3] Es ist fest gebunden und entspricht funktionell QA im Photosystem II.
Vitamin-K-Zyklus
[Bearbeiten | Quelltext bearbeiten]
Das Peroxid des Vitamin K führt unter Veränderung zum Epoxid des Vitamin K zur Deprotonierung des Proteins (z. B. des Gerinnungsfaktors). Das Protein wird mittels CO2 und Energie aus ATP zum γ-carboxylierten Protein (oder Vitamin K-abhängigem Gerinnungsfaktor).
Das Epoxid des Vitamin K wird mittels Vitamin-K-Epoxid-Reduktase zum Chinon des Vitamin K. Das Chinon des Vitamin K wird mittels Carbonylreduktase zum Hydrochinon des Vitamin K. Diese beiden Schritte können durch die Herzinfarkt-Medikamente Dicumarol, Marcumar und Warfarin inhibiert werden.
Das Hydrochinon des Vitamin K wird zum Peroxid des Vitamin K. Der Zyklus beginnt von vorn.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Vitamin K1 findet sich in den Lamellarmembranen der Chloroplasten in grünen Pflanzen. Der aromatische Ring der K-Vitamine wird im Shikimisäureweg gebildet. Im Körper ist das Vitamin K im Blutplasma vorhanden und in der Leber, Niere und Milz gespeichert.
Phyllochinon kommt insbesondere in grünen, blattförmigen Pflanzen vor, z. B. in grünem Gemüse (Rosenkohl, Grünkohl, Spinat, Brokkoli) oder Salaten.[7] Auch Öle tragen zur Vitamin K1-Versorgung bei.[8] Dagegen haben Fleisch und Fisch mittlere Gehalte, Früchte sind eher Vitamin K1-arm. Der angegebene Gehalt schwankt in verschiedenen Tabellenwerken zum Teil erheblich. Neben Problemen in der Analytik hängt der gemessene Gehalt auch von der Jahreszeit ab.[7]
| Nahrungsmittel | Tabellenwerk
Schek[8] |
Tabellenwerk
Souci/Fachmann/Kraut[9] |
|---|---|---|
| Nattō | 34,7 | kA |
| Hartkäse | 10,4 | 2,6[10] |
| Weichkäse | 2,6 | kA |
| Sauerkraut | 25,1 | 7,7 |
| Schweinesteak | 0,3 | kA |
| Eigelb | 2,1 | (8,9)[11] |
| Butter | 14,9 | 7,0 |
| Salami | 2,3 | kA |
| Schlagsahne | 5,1 | kA |
| Eiklar | 0 | kA |
| Milch | 0 | 0,5 |
| Schwarzer Tee | 0,3 | 262 |
| Makrele | 2,2 | 7,1 |
| Grünkohl | 817 | 817 |
| Spinat | 387 | 305 |
| Brokkoli | 156 | 155 |
| Margarine | 93,2 | kA |
| Sojaöl | 193 | 138 |
| Rapsöl | 127 | 150 |
| Olivenöl | 53,7 | 33 |
| Schokolade | 6,6 | kA |
| Apfel | 3,0 | 3,7 |
| Banane | 0,3 | 0,3 |
Bedarf
[Bearbeiten | Quelltext bearbeiten]Die EFSA gibt als empfohlene Tagesdosis (Adequate Intake) für alle Alters- und Geschlechtsgruppen eine Aufnahmemenge von 1 µg/kg Körpergewicht Phyllochinon an.[12] Sie differenziert hierbei aber nicht weiter zwischen der Aufnahme von Vitamin K1 und K2. Anhand Referenzkörpergewichte empfiehlt die EFSA Säuglingen zwischen 7 und 11 Monaten täglich etwa 10 µg Vitamin K, bei Personen über 18 Jahren etwa 70 µg.[13] Anfang des Jahres 2017 wurde diese bereits im Jahre 1993[8] formulierte Zufuhrempfehlung erneut bestätigt. Das Bundesinstitut für Risikobewertung (BfR) gibt ähnliche Werte für die D-A-CH-Region an, unterscheidet aber bei Jugendlichen und Erwachsenen nach Geschlecht. So werden von 15 bis 51 Jahren 70 µg (Männer) bzw. 60 µg (Frauen) empfohlen. Im Alter erhöht sich der Bedarf: Bei ab 65-Jährigen liegt die Tagesempfehlung bei 80 µg (Männer) bzw. 65 µg (Frauen). Schwangere und Stillende sollen 60 µg täglich einnehmen.
Bei Neugeborenen wird zur Vermeidung von lebensbedrohlichen Blutungen durch einen möglichen Vitamin-K-Mangel so bald wie möglich die Gabe von Vitamin K1 nach der Geburt, also noch im Kreißsaal, dringend empfohlen.[14]
Das Bundesinstitut für Risikobewertung gibt eine Tagesverzehrempfehlung von Vitamin K1 in Nahrungsergänzungsmitteln von maximal 80 µg an.[12] Zudem sollen Personen, die gerinnungshemmende Medikamente (vom Cumarintyp) einnehmen, vor dem Verzehr von Vitamin K-haltigen Nahrungsergänzungsmitteln ärztlichen Rat einholen.
Mangelerscheinungen (Hypovitaminose)
[Bearbeiten | Quelltext bearbeiten]Ein Vitamin-K-Mangel beim Menschen ist – mit der Ausnahme von Neugeborenen – eher selten,[15][8] zumal es sich um ein fettlösliches Vitamin handelt und die Speicherreserven des Körpers damit nicht so rasch erschöpft werden wie im Fall der wasserlöslichen Vitamine. Chronische Magen- und Darmerkrankungen (Durchfall, Zöliakie, Fettverdauungsstörungen wie beispielsweise bei Gallengangsverschluss oder einer exokrinen Pankreasinsuffizienz, Morbus Crohn) fördern einen Vitamin-K-Mangel; die Vitamin K-Aufnahme kann auch aufgrund eines Kurzdarmsyndroms reduziert sein.[15] Falls die Leber beschädigt ist, kann dies zu einer unzureichenden Verwertung von Vitamin K führen. Bei langfristiger Einnahme bestimmter Medikamente wie Antibiotika, Medikamente gegen Epilepsie oder Tuberkulose, Medikamenten zur Hemmung der Blutgerinnung sowie bei langandauernder Einnahme von Salicylaten können Mangelerscheinungen auftreten.[15]
Weiterhin kommt es auch häufig bei Osteoporose, wo ein erhöhter Verlust von Calcium typisch ist, zu einem Vitamin-K-Mangel.
Kommt es aber zu einem Mangel an Vitamin K, so tritt eine Verlangsamung der Blutgerinnung ein. Bei Säuglingen kann es zu Hirnblutungen kommen. Verdauungsstörungen, chronische Lebererkrankungen und Blutungen in verschiedenen Geweben und Organen, wie beispielsweise an der Nasenschleimhaut, im Magen-Darm-Trakt und in der Muskulatur, sind möglich.
Folgen einer Überdosierung (Hypervitaminose)
[Bearbeiten | Quelltext bearbeiten]Eine tolerierbare obere Einnahmemenge (Tolerable Upper Intake Level) wurde aufgrund unzureichender Daten nicht abgeleitet.[12]
Bei Überdosierung können selten allergische Überempfindlichkeitsreaktionen auftreten.[15] Einige Menschen haben einen Gendefekt, bei dem es durch Überdosierung von Vitamin K zu Thrombosen kommen kann. Ein Gentest dafür ist verfügbar.
Antagonisten
[Bearbeiten | Quelltext bearbeiten]

Man weiß, dass Vitamin K zur Synthese von Gerinnungsfaktoren (Prothrombin) unerlässlich ist. Die Gegenwart von Vitamin-K-Antagonisten (z. B. Warfarin, Dicumarol) klärte die Wirkungsweise dieses Vitamins erstmals auf. So führte das in verdorbenem Klee vorhandene Dicumarol zu lebensgefährlichen Blutungen bei Rindern. Warfarin findet auch als Rattengift Verwendung. Mit Dicumarol gefütterte Kühe besitzen ein abnormes Prothrombin, das anders als das normale Prothrombin kein Ca2+ mehr bindet. Dies kommt durch die Änderung einer Aminosäure im Prothrombin zustande.
Als Medikament zur Blutgerinnungshemmung wird häufig Phenprocoumon als Antagonist verwendet.
Biosynthese
[Bearbeiten | Quelltext bearbeiten]
Nur Landpflanzen, Grünalgen und manche Cyanobakterien können die Biosynthese von Phyllochinon durchführen.[2]
- In Pflanzen entsteht das aromatische Grundgerüst im Zuge des Shikimisäureweges aus Chorismat, die Reaktionen finden in den Plastiden und Peroxisomen statt und münden in der Bildung von 1,4-Dihydroxy-2-naphthoat. Insgesamt ähnelt die Biosynthese Phyllochinons der von Menachinon (Vitamin K2) in E. coli.
- Die Phytylseitenkette kann aus zwei metabolischen Zweigen erzeugt werden. Entweder werden Dimethylallylpyrophosphat und drei Molekülen Isopentenylpyrophosphat über Zwischenschritte zu Geranylgeranylpyrophosphat umgesetzt, nach Reduktion mittels NADPH entsteht Phytylpyrophosphat. Dieses wird an den Aromaten kondensiert, so dass eine Vorstufe zum Phyllochinon entsteht. Weitere Reduktionen und die Anlagerung von Methyl aus SAM bilden daraus Phyllochinon. Alternativ kann Phytylpyrophosphat auch aus dem Abbau von Chlorophyllen gewonnen werden.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]KA-Vit (D), Konakion (D, A, CH)
FrekaVit (D), Vitalipid (D, A, CH)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Vitamin K in Lebensmitteln (PDF), Deutsche Herzstiftung, Mai 2020[17]
- Vitamin K-Produkte – was ist sinnvoll?, Verbraucherzentrale, 11. Oktober 2021
- Uwe Gröber und Klaus Kisters: Ein altes Vitamin in neuem Licht, Deutsche Apotheker Zeitung, 22. Mai 2014
Literatur
[Bearbeiten | Quelltext bearbeiten]- O. Isler: Über die Vitamine K1 und K2. In: Angewandte Chemie. Band 71, Nr. 1, 1959, S. 7–15, doi:10.1002/ange.19590710103.
- Dietary reference values for vitamin K (PDF, englisch), EFSA, 22. Mai 2017, doi:10.2903/j.efsa.2017.4780.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Phylloquinone (K1), analytical standard bei Sigma-Aldrich, abgerufen am 25. Juni 2017 (PDF).
- ↑ a b Gilles J. Basset et al.: Phylloquinone (Vitamin K1): Occurrence, Biosynthesis and Functions. In: Mini Reviews in Medicinal Chemistry. Band 17, Nr. 12, 2017, S. 1028–1038, doi:10.2174/1389557516666160623082714, PMID 27337968.
- ↑ a b Hans-Walter Heldt, Birgit Piechulla: Pflanzenbiochemie. 5. Auflage. Springer-Verlag, 2014, ISBN 978-3-662-44398-9, S. 96, doi:10.1007/978-3-662-44398-9.
- ↑ M. J. Shearer: Vitamin K. In: Lancet. Band 345, Nummer 8944, Januar 1995, S. 229–234, PMID 7823718 (Review).
- ↑ R. T. Weibert, D. T. Le, S. R. Kayser, S. I. Rapaport: Correction of excessive anticoagulation with low-dose oral vitamin K1. In: Annals of internal medicine. Band 126, Nummer 12, Juni 1997, S. 959–962, PMID 9182473.
- ↑ Sekundäre Hämostase – Teil 3 – Gerinnung an negativen Oberflächen – Vitamin K auf YouTube, abgerufen am 3. Juni 2016.
- ↑ a b Klaus Pietrzik, Ines Golly, Dieter Loew: Handbuch Vitamine: Für Prophylaxe, Therapie und Beratung. 1. Auflage. Urban&Fischer, Elsevier, München 2008, ISBN 978-3-437-55361-5, S. 365.
- ↑ a b c d Alexandra Schek: Vitamin K – ein Update, Teil 1. In: Ernährungs-Umschau. 14. November 2017, abgerufen am 31. März 2022.
- ↑ Souci/Fachmann/Kraut: Die Zusammensetzung der Lebensmittel, Nährwert-Tabellen. Hrsg.: Deutsche Forschungsanstalt für Lebensmittelchemie im Auftrag des Bundesministeriums für Ernährung und Landwirtschaft. 8. Auflage. MedPharm Scientific Publishers, Stuttgart 2016, ISBN 978-3-8047-5072-2.
- ↑ Emmentalerkäse
- ↑ Gesamt-Ei
- ↑ a b c Höchstmengenvorschläge für Vitamin K in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) BfR, abgerufen am 30. März 2022.
- ↑ Dominique Turck et al.: Dietary reference values for vitamin K. In: EFSA Journal. Band 15, Nr. 5, Mai 2017, doi:10.2903/j.efsa.2017.4780, PMID 32625486, PMC 7010012 (freier Volltext).
- ↑ Prophylaxe von Vitamin-K-Mangel-Blutungen (VKMB) bei Neugeborenen. (PDF) In: AWMF. März 2016, S. 10, abgerufen am 31. März 2022.
- ↑ a b c d Vitamin K-Produkte – was ist sinnvoll? In: Verbraucherzentrale. 11. Oktober 2021, abgerufen am 31. März 2022.
- ↑ Sigrun Reumann: Biosynthesis of Vitamin K1 (Phylloquinone) by Plant Peroxisomes and Its Integration into Signaling Molecule Synthesis Pathways. In: Luis A. del Río (Hrsg.): Peroxisomes and their Key Role in Cellular Signaling and Metabolism. Springer, Dordrecht 2013, doi:10.1007/978-94-007-6889-5_12.
- ↑ gemäß dort verwendeter Quelle (Souci/Fachmann/Kraut: Die Zusammensetzung der Lebensmittel – Nährwert-Tabellen, 8., revidierte und ergänzte Auflage 2016, ISBN 978-3-8047-5072-2, hrsg. von der Deutschen Forschungsanstalt für Lebensmittelchemie im Auftrag des Bundesministeriums für Ernährung und Landwirtschaft) S. XVII handelt es sich um Vitamin K1