Polyoxymethylene
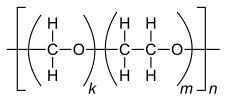
| Allgemeine Strukturen von Polyoxymethylenen |
 |
 |
 |
Polyoxymethylene (Kurzzeichen POM, auch Polyacetale genannt) sind hochmolekulare thermoplastische Kunststoffe. Die farblosen, teilkristallinen Polymere werden hauptsächlich zur Herstellung von Formteilen im Spritzgussverfahren verwendet. Wegen der hohen Steifigkeit, niedrigen Reibwerten und guter Dimensionsstabilitäten werden Polyoxymethylene für die Herstellung von Präzisionsteilen eingesetzt. Kennzeichnendes Strukturelement ist eine unverzweigte Acetal-Gruppe (~C–O–CH2–O–C~).
Das aus Formaldehyd hergestellte Homopolymer wird als POM-H bezeichnet und hat die Struktur –(CH2–O–)n (Oxymethylen-Gruppen). Die Copolymere (Kurzzeichen POM-C) haben neben zahlreichen Acetal-Gruppen auch –(CH2)m–O–-Einheiten mit 2 oder 4 Methylen-Gruppen. Sie dienen zur thermischen Stabilisierung des Polymers. POM-C hat ähnliche Eigenschaften wie POM-H.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Polyoxymethylen fällt spontan aus ungehemmten wässrigen Lösungen von Formaldehyd aus und wurde 1859 von Alexander Michailowitsch Butlerow isoliert.[1]
In den 1920er Jahren untersuchten Hermann Staudinger und Werner Kern systematisch die Polymerisation von Formaldehyd. Es gelang jedoch nicht, stabilisierte Polymere mit ausreichend hohem Polymerisationsgrad herzustellen.[2] In den 1940er Jahren wurde die Gewinnung von reinem Formaldehyd von DuPont erforscht und es gelang die Herstellung von POM-H, die 1956 patentiert wurde. Ab Ende der 1950er Jahre wurde POM-H produziert und mit dem Handelsnamen Delrin vermarktet.
Celanese (Vereinigte Staaten) entwickelte POM-C, das ab 1961 unter dem Handelsnamen Celcon vertrieben wurde. In einem Joint Venture mit Hoechst (heute Ticona Kelsterbach) wurde POM-C in Deutschland hergestellt und wird unter dem Handelsnamen Hostaform vertrieben.[3] 1971 kam POM-C unter dem Namen Ultraform (BASF) auf den Markt.[3]
Weitere Handelsnamen sind Kocetal, Ramtal, Duracon, Kepital und Polypenco.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Eigenschaften | POM-H | POM-C |
| CAS-Nummer | 9002-81-7 | 24969-26-4 |
| Dichte | 1,43 g/cm3[4] | 1,41 g/cm3[5] |
| Schmelztemperatur | 182 °C[4] | 166 °C[5] |
| Glasübergangstemperatur | −60 °C[4] | −60 °C[5] |
| Kurzzeitige, max. Anwendungstemperatur | 150 °C[4] | 140 °C[5] |
| Langzeitige, max. Anwendungstemperatur | 110 °C[4] | 100 °C[5] |
| Thermischer Ausdehnungskoeffizient 23–100 °C | 23·10−5·K−1[4] | 14·10−5·K−1[5] |
| Kugeldruckhärte | 185 MPa[4] | 165 MPa[5] |
| Gleitreibungskoeffizient gegen Stahl | 0,34[4] | 0,32[5] |
| Spezifischer Oberflächenwiderstand nach DIN EN 61340-2-3 | 1,00·10+14 Ω[4] | 1,00·10+14 Ω[5] |
| Wasseraufnahme | 0,050 %[4] | 0,050 %[5] |
| Beständigkeit gegen heißes Wasser/Laugen | unbeständig[4] | bedingt beständig[5] |
POM zeichnet sich durch hohe Festigkeit, Härte und Steifigkeit in einem weiten Temperaturbereich aus. Es behält seine hohe Zähigkeit, weist eine hohe Abriebfestigkeit, einen niedrigen Reibungskoeffizienten, eine hohe Wärmeformbeständigkeit, gute Gleiteigenschaften, gute elektrische und dielektrische Eigenschaften sowie eine geringe Wasseraufnahme auf. Die Eigenfarbe ist wegen der hohen Kristallinität opak weiß, aber das Material ist in allen Farben gedeckt einfärbbar.[6]
Die Kristallinität von POM-H erreicht 80 %[6] und liegt etwas höher als bei POM-C mit bis zu 75 %.[7] Der Kristallitschmelzpunkt von POM-H liegt bei 175 °C und von POM-C bei 164 bis 172 °C.[6] Wegen des höheren Kristallitschmelzpunktes hat POM-H eine etwas bessere Wärmebeständigkeit. POM-C ist etwas beständiger gegen Alkalien und heißes Wasser. Allgemein hat POM eine geringe Witterungsbeständigkeit.[6] Bei zu hohen Verarbeitungstemperaturen oder Erhitzen über 220 °C beginnt POM sich thermisch zu zersetzen. Es bildet sich u. a. Formaldehyd, das einen stechenden und reizenden Geruch hat.
POM ist gut spanbar und ist daher ein bevorzugter Plastwerkstoff zur spanenden Bearbeitung von Maschinen- und Apparateteilen.
POM ist ohne spezielle Oberflächenbehandlung nur bedingt klebbar. Durch spezielles Beizen der Oberfläche lässt sich die Haftung von Klebstoffen (meist Epoxidharze) verbessern.[8]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Man unterscheidet zwischen dem Homo- und Copolymer, welche nach unterschiedlichen Verfahren hergestellt werden können.
Homopolymer
[Bearbeiten | Quelltext bearbeiten]| Monomere | |
 Formaldehyd |
 Trioxan |
Polyoxymethylen-Homopolymer (POM-H) hat die Struktur –(CH2–O–)n und wird aus Formaldehyd oder aus Trioxan hergestellt. Daher wird POM-H auch als Polyformaldehyd bzw. als Polytrioxan bezeichnet. Polyoxymethylen kann durch kationische ringöffnende Kettenpolymerisation von Trioxan erhalten werden. POM-H wird jedoch meist durch anionische Kettenpolymerisation von Formaldehyd erhalten. In beiden Fällen enden die entstehenden Makromoleküle als weniger stabile Halbacetale (R–CH2–O–CH2–OH). Unter Säureeinfluss oder thermischer Belastung führt dies zu einer Depolymerisation unter Freisetzung von Formaldehyd. Zur Stabilisierung werden die Endgruppen durch Veresterung verschlossen.
Polyformaldehyd
[Bearbeiten | Quelltext bearbeiten]Formaldehyd wird in einer Suspensionspolymerisation in Cyclohexan als Lösemittel hergestellt. Im ersten Schritt wird wasserfreies Formaldehyd gewonnen. Unter Hitze wird das vergleichsweise kurzkettige Paraformaldehyd zu Formaldehyd depolymerisiert:[9]
Initiierung der Polymerisation erfolgt durch eine Base wie Natriummethanolat.
Das Wachstum erfolgt in einer anionischen Kettenpolymerisation.
Abbruch tritt durch Spuren von Wasser oder Methanol auf.
Eine Stabilisierung des Polymers gegen thermische Depolymerisation erfolgt durch eine Umsetzung mit Essigsäureanhydrid.
Polytrioxan
[Bearbeiten | Quelltext bearbeiten]Trioxan wird durch Trimerisierung von Formaldehyd in saurer wässriger Lösung gewonnen. Die Cyclisierung erfolgt in einer nukleophilen Addition vom Carbonyl-O an das Carbonyl-C eines benachbarten Aldehyd-Moleküls.[10]
Die Polymerisation von Trioxan erfolgt als kationische ringöffnende Kettenpolymerisation. Als Katalysatoren dienen starke Protonensäuren wie Schwefelsäure, Trifluoressigsäure oder Bortrifluorid BF3 (auch in Form von Bortrifluoriddiethyletherat) und Salze wie Eisen(III)-chlorid (FeCl3) und Zinn(IV)-chlorid (SnCl4) werden verwendet.
Der kationische Initiator lagert sich an ein Sauerstoffatom des Trioxan an führt im ersten Schritt zur Bildung eines Oxonium-Ions. In einer Startphase kommt es nur zur Bildung von Formaldehyd und Oligomeren. Das System strebt dann ein Gleichgewicht zwischen Formaldehyd und Oligomeren an. Danach setzt erst die Propagation zu Makromolekülen ein.[11]
Eine Stabilisierung des Polymers gegen thermische Depolymerisation ist auch hier erforderlich. Naheliegend ist der Zusatz von anderen cyclischen Ethern wie Dioxolan, was zu einem stabilen Copolymerisat führt.[12]
Copolymer
[Bearbeiten | Quelltext bearbeiten]| Comonomere | ||
Oxiran |
 Dioxolan |
 1,3-Dioxepan |
Die Copolymere (POM-C) werden in einer kationischen ringöffnenden Copolymerisation von Trioxan mit Oxiran, Dioxolan oder 1,3-Dioxepan hergestellt. Der Anteil des Comonomers liegt im Bereich von 2–4 %.[7] Die Comonomere werden statistisch verteilt in das wachsende Polymer eingebaut.
Zur thermischen Stabilisierung der Makromoleküle mit instabilen Halbacetalen als Endgruppe werden durch Hydrolyse mit NH3 heterogen bei 100 °C oder in homogener Schmelze bei 170–220 °C Formaldehyd abgespalten, bis kein Halbacetal als Endgruppe mehr vorliegt.
Verarbeitung
[Bearbeiten | Quelltext bearbeiten]
Das Material kann durch Spritzguss bei 180 bis 220 °C (POM-H)[13] bzw. 180 bis 230 °C (POM-C) verarbeitet werden. Auch durch Extrusionsblasformen lässt es sich verarbeiten. POM-Halbzeug ist gut zur spanenden Weiterverarbeitung geeignet.
Verwendung
[Bearbeiten | Quelltext bearbeiten]
POM-Granulat wird für Spritzgussteile verwendet. Als Halbzeug ist es zur spanenden Weiterverarbeitung z. B. als extrudiertes Profil erhältlich[15]; es ist besser als die meisten anderen Plastwerkstoffe spanbar.
- Maschinenbau: Zahnräder, Gleit- und Führungselemente, Gehäuseteile, Federelemente, Ketten, Schrauben, Muttern, Lüfterräder, Pumpenteile, Ventilkörper
- Elektrotechnik: Isolatoren, Spulenkörper, Steckverbinder, Teile für elektronische Geräte, z. B. Fernseher und Telefone
- Fahrzeugbau: Lenkstock (u. a. Schalthebel für Licht, Blinker), Fensterheber, Türschlosssysteme, Gelenkschalen
- Modellbau: dünnwandige, höher beanspruchte Teile bei Modellbahnen, etwa Drehgestelle und Griffstangen. POM bricht bei Belastung weniger leicht als ABS, ist jedoch in hellen Farben transluzent und nicht lackierbar.
- Medizin: Insulinpen
- Möbelbau: Beschläge, Schlösser, Griffe, Scharniere oder auch Gardinenrollen
- Bauwesen: Hülsen für Punkthalter im konstruktiven Glasbau
- Verpackung: Aerosoldosen, Fahrzeugtanks, Gasampullen
- Sport: Paintballzubehör, insbesondere Bolzen
- Bekleidung: Reißverschlüsse
- Musik: Tortex-Plektra für Zupfinstrumente als Ersatz für Plektra aus Schildpatt; Delrin-Kiele für Cembali als Ersatz für Rabenfederkiele; einige Blasinstrumente, insbesondere Irische Querflöten und Tin Whistles
- Gastronomie: die Brühgruppe in Kaffee-Vollautomaten
- Physikalische Chemie: die verschiebbare Barriere der Filmwaage. Das hydrophobe Material ist schwer genug, um das Hindurchschlüpfen der Monolage zu verhindern.
- Feuerzeuge: Gehäuse
- E-Zigarette: Driptips
Die Verwendung von POM zur Herstellung von Gegenständen, die in Kontakt mit Lebensmitteln kommen, ist im Lebensmittel-, Bedarfsgegenstände- und Futtermittelgesetzbuch geregelt. Verwendet werden darf nur POM mit einem Schmelzindex von maximal 50 g pro 10 min (MFI 190/2,16). Zudem sind die maximal zulässigen Anteile von Katalysatoren und anderen für die Herstellung und Verarbeitung notwendigen Stoffen geregelt. Für die Aufbewahrung und Verpackung von sauren Füllgütern mit einem pH-Wert unter 2,5 ist POM nicht geeignet.[16]
Marktanteile
[Bearbeiten | Quelltext bearbeiten]Marktführer auf dem ca. 780.000 t großen POM-Markt waren 2006:[17]
- ca. 25 %: Ticona
- ca. 20 %: DuPont
- ca. 20 %: Polyplastics
- ca. 10 %: Mitsubishi Gas Chemical
- ca. 10 %: KEP
- ca. 15 %: andere
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Charles E. Carraher Jr: Giant Molecules: Essential Materials for Everyday Living and Problem Solving. John Wiley & Sons, 2003, ISBN 978-0-471-45721-3, S. 192 (books.google.com).
- ↑ Wolfgang Kaiser, Kunststoffchemie für Ingenieure, 3. Auflage, Carl Hanser, München, 2011, S. 389.
- ↑ a b Sigrid Lüftl, P. M. Visakh, Sarath Chandran: Polyoxymethylene Handbook: Structure, Properties, Applications and Their Nanocomposites, Wiley, New Jersey, 2014, S. 2f. (Eingeschränkte Vorschau)
- ↑ a b c d e f g h i j k KUNDERT AG Kunststoff-Datenbank, Eintrag POM-H
- ↑ a b c d e f g h i j k KUNDERT AG Kunststoff-Datenbank, Eintrag POM-C
- ↑ a b c d Wolfgang Kaiser, Kunststoffchemie für Ingenieure, 3. Auflage, Carl Hanser, München, 2011, S. 384f.
- ↑ a b Bernd Tieke: Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 128.
- ↑ Gerd Habenicht: Kleben: Grundlagen, Technologie, Anwendungen, Springer-Verlag, Berlin, 2013, S. 616. (Eingeschränkte Vorschau)
- ↑ Bernd Tieke: Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 113.
- ↑ Eberhard Breitmaier, Günther Jung: Organischen Chemie, 7. Aufl., Thieme, Stuttgart, 2012, S. 321.
- ↑ Olagoke Olabisi, Kolapo Adewale: Handbook of Thermoplastics, CRC-Press, Boca Raton, 2016, S. 268. (Eingeschränkte Vorschau)
- ↑ Wolfgang Kaiser: Kunststoffchemie für Ingenieure, 3. Auflage, Carl Hanser, München, 2011, S. 386ff.
- ↑ Bernd Tieke: Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 116.
- ↑ Beschreibung bei Duran-Gruppe.
- ↑ Halbzeug-Beispiele bei Firma Kern, abgerufen am 18. Mai 2021
- ↑ Kunststoffe im Lebensmittelverkehr Carl Heymanns Verlag KG, XXXIII. Acetalharze, Stand 1. Juni 2007.
- ↑ Polyoxymethylen (POM), kunststoffe.de.
![{\displaystyle \mathrm {HO({-}CH_{2}{-}O)_{\mathit {n}}{-}H\ \ {\xrightarrow[{}]{\Delta }}\ \ {\mathit {n}}\ H_{2}C{=}O\ +\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/91837070991a5af2211213634509829d2a41c737)







![{\displaystyle \mathrm {R{-}O{-}CH_{2}{-}O{-}CH_{2}{-}CH_{2}{-}O{-}CH_{2}{-}O{-}CH_{2}{-}OH\ \ {\xrightarrow[{}]{\Delta }}\ \ R{-}O{-}CH_{2}{-}O{-}CH_{2}{-}CH_{2}{-}O{-}H\ +\ 2\ H_{2}C{=}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ab91a9cd01f968d413596f5323a8233b3155f6e)