Sulfoxidation
Als Sulfoxidation bezeichnet man ein großtechnisches Verfahren zur Herstellung von Alkansulfonaten. Im Verlauf der Reaktion erfolgt ein Austausch (Substitution) von Wasserstoff durch -SO3H in Alkanen. Diese Reaktion ist eine radikalische Substitution.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Sulfoxidation wurde 1940 im Werk Hoechst der damaligen IG Farben AG entdeckt, als Paraffine mit Schwefeldioxid und Sauerstoff bei Einstrahlung von UV-Licht behandelt wurden. Dieses Verfahren wurde in den Jahren 1941 bis 1944 weiterentwickelt, wobei Alkansulfonate als waschaktive Substanzen in kleinen technischen Anlagen nach dem Licht-Wasser-Verfahren in Hoechst und nach dem Essigsäureanhydrid-Verfahren in Leuna hergestellt wurden. Erst zehn Jahre nach dem Zweiten Weltkrieg interessierte man sich wieder für die Sulfoxidation. So entwickelte die Firma ESSO ein neues Verfahren mit Hilfe von Gamma-Strahlen. Außerdem wurden Verfahren mit Ozon und Zumischung kleinerer Mengen von Chlor als Radikalbildner untersucht. Durchgesetzt hat sich danach aber das Licht-Wasser-Verfahren.
Reaktionsablauf
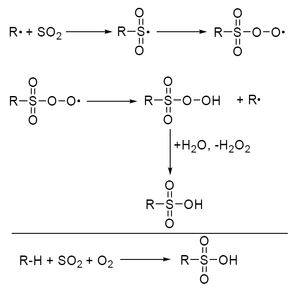
[Bearbeiten | Quelltext bearbeiten]Alkane reagieren mit Schwefeldioxid und Sauerstoff unter dem Einfluss von Licht oder Radikalstartern zu einem Gemisch von Alkansulfonaten.
Die Alkane werden in Gegenwart eines Gemisches von SO2/O2 mit UV-Licht bei 30 bis 38 °C bestrahlt. Zudosiertes Wasser hydrolysiert die intermediär gebildeten Alkanpersulfonate zu Sulfonsäuren. Zur Vermeidung höhersulfononierter Verbindungen wird der Umsatz auf wenige Prozent begrenzt.
Die Endprodukte dieser radikalischen Kettenreaktion, die technisch an langkettigen Alkanen erfolgt, sind wertvolle Zwischenprodukte für die Herstellung von Tensiden.
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. Ramloch, G. Täuber: Moderne Verfahren der Großchemie: Die Sulfoxidation, Chemie in unserer Zeit, 13. Jahrg. 1979, Nr. 5, S. 157–163, ISSN 0009-2851
- Falbe (Hrsg.), „Surfactants in consumer products“, S. 70–71, Berlin: Springer 1986.