„Hofmannscher Wasserzersetzungsapparat“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Änderungen von 2A02:908:1A8:4480:A9A2:2C8A:7291:59EF (Diskussion) auf die letzte Version von 217.232.194.97 zur… |
Reaktionsgleichung, Einzelnachweis |
||
| Zeile 1: | Zeile 1: | ||
[[Datei:Hofmann voltameter.svg|mini|Hofmannscher Elektrolyseapparat]] |
[[Datei:Hofmann voltameter.svg|mini|Hofmannscher Elektrolyseapparat]] |
||
Der '''Hofmannsche Wasserzersetzungsapparat''', '''Hofmannsche Zersetzungsapparat''' oder '''Wasserzersetzungsapparat nach Hofmann''' ist ein Gerät zur [[Elektrolyse|elektrolytischen]] Zerlegung von [[Wässrige Lösung|wässrigen Lösungen]] und wurde nach [[August Wilhelm Hofmann]] (1818–1892) benannt, der diesen Versuchsaufbau z. B. in seinem 1866 erschienenen Buch beschrieben hat.<ref name="August Wilhelm Hofmann">{{Literatur | |
Der '''Hofmannsche Wasserzersetzungsapparat''', '''Hofmannsche Zersetzungsapparat''' oder '''Wasserzersetzungsapparat nach Hofmann''' ist ein Gerät zur [[Elektrolyse|elektrolytischen]] Zerlegung von [[Wässrige Lösung|wässrigen Lösungen]] und wurde nach [[August Wilhelm Hofmann]] (1818–1892) benannt, der diesen Versuchsaufbau z. B. in seinem 1866 erschienenen Buch beschrieben hat.<ref name="August Wilhelm Hofmann">{{Literatur |Autor=August Wilhelm Hofmann |Titel=Introduction to modern chemistry: experimental and theoretic; embodying… |Verlag=Walton and Maberly |Datum=1866 |Seiten=55 |Online={{Google Buch | BuchID = KT8JAAAAIAAJ | Seite = 55 }}}}</ref> Der Versuchsaufbau wurde auch als ein [[Voltameter]] benutzt. |
||
== Funktion == |
== Funktion == |
||
Er dient zur Demonstration der [[Elektrolyse|elektrolytischen]] Zersetzung beispielsweise von [[Wasser]]. In diesem Fall wird die komplette Apparatur meistens mit verdünnter [[Schwefelsäure]] gefüllt, da reines Wasser keine ausreichende elektrische Leitfähigkeit besitzt. Nach dem Anlegen einer [[Gleichspannung]] an den [[Platin]]elektroden oder [[Kohle]]elektroden findet eine Gasentwicklung an [[Kathode]] und [[Anode]] statt. |
Er dient zur Demonstration der [[Elektrolyse|elektrolytischen]] Zersetzung beispielsweise von [[Wasser]]. In diesem Fall wird die komplette Apparatur meistens mit verdünnter [[Schwefelsäure]] gefüllt, da reines Wasser keine ausreichende elektrische Leitfähigkeit besitzt.<ref>{{Literatur |Autor=Peter Kurzweil |Titel=Chemie |Verlag=Springer Vieweg |Ort=Wiesbaden |Datum=2015 |Seiten=198 |DOI=10.1007/978-3-658-08660-2 |ISBN=978-3-658-08660-2}}</ref> Nach dem Anlegen einer [[Gleichspannung]] an den [[Platin]]elektroden oder [[Kohle]]elektroden findet eine Gasentwicklung an [[Kathode]] und [[Anode]] statt. |
||
Dabei wird das Wasser in seine beiden Bestandteile [[Sauerstoff]] und [[Wasserstoff]] zerlegt. Die entstehenden Gase sammeln sich in den beiden Messrohren und können mit Hilfe eines Hahns entnommen werden. |
Dabei wird das Wasser in seine beiden Bestandteile [[Sauerstoff]] und [[Wasserstoff]] zerlegt. Die entstehenden Gase sammeln sich in den beiden Messrohren und können mit Hilfe eines Hahns entnommen werden. |
||
An der Kathode werden die [[Oxonium]]ionen, welche durch [[Protolyse]] der zugesetzen Säure entstanden sind, zu Wasserstoff [[Reduktion (Chemie)|reduziert]] und an der Anode das Wasser zu Sauerstoff und zu Oxoniumionen [[Oxidation|oxidiert]]. |
An der Kathode werden die [[Oxonium]]ionen, welche durch [[Protolyse]] der zugesetzen Säure entstanden sind, zu Wasserstoff [[Reduktion (Chemie)|reduziert]] und an der Anode das Wasser zu Sauerstoff und zu Oxoniumionen [[Oxidation|oxidiert]]. |
||
| Zeile 19: | Zeile 19: | ||
Die positiv geladenen Oxoniumionen, die sich in der Nähe der negativ geladenen Elektrode, der Kathode, befinden, werden durch die negative Ladung angezogen und dort unter Wasserstofffreisetzung entladen (kathodische Reduktion). |
Die positiv geladenen Oxoniumionen, die sich in der Nähe der negativ geladenen Elektrode, der Kathode, befinden, werden durch die negative Ladung angezogen und dort unter Wasserstofffreisetzung entladen (kathodische Reduktion). |
||
Im Bereich der positiv geladenen Elektrode, der Anode, werden dem Wasser Elektronen entzogen (anodische Oxidation). Die oxidierten Wasserteilchen sind instabil und zerfallen unter Freisetzung von Sauerstoff und Bildung von Oxoniumionen. |
Im Bereich der positiv geladenen Elektrode, der Anode, werden dem Wasser Elektronen entzogen (anodische Oxidation). Die oxidierten Wasserteilchen sind instabil und zerfallen unter Freisetzung von Sauerstoff und Bildung von Oxoniumionen. |
||
Die Oxoniumionen müssen nicht durch die Lösung zur Kathode wandern, sie geben vielmehr ihre positive Ladung über eine Umorientierung der Wasserstoffbrückenbindungen durch die Lösung bis zur Kathode weiter |
Die Oxoniumionen müssen nicht durch die Lösung zur Kathode wandern, sie geben vielmehr ihre positive Ladung über eine Umorientierung der Wasserstoffbrückenbindungen durch die Lösung bis zur Kathode weiter: |
||
[[Datei:Protonenleitung.svg|zentriert|Protonenleitung beim Hofmannschen Wasserzersetzungsapparat]] |
|||
Diese Form der elektrischen Leitung wird Protonenleitung genannt.<ref>Skript des Schülerlabors Quantensprung der Helmholtz Gesellschaft: [http://www.hzg.de/imperia/md/content/gkss/zentrale_einrichtungen/quantensprung/wasserstoff_a5_hzg_2010.pdf Wasserstoff und Brennstoffzelle] (PDF; 8,3 MB).</ref> |
Diese Form der elektrischen Leitung wird Protonenleitung genannt.<ref>Skript des Schülerlabors Quantensprung der Helmholtz Gesellschaft: [http://www.hzg.de/imperia/md/content/gkss/zentrale_einrichtungen/quantensprung/wasserstoff_a5_hzg_2010.pdf Wasserstoff und Brennstoffzelle] (PDF; 8,3 MB).</ref> |
||
| Zeile 30: | Zeile 31: | ||
== Weblinks == |
== Weblinks == |
||
{{Commonscat|Hofmann voltameter|Hofmannscher Zersetzungsapparat}} |
|||
* {{Webarchiv | url=http://www.schoenhacker.at/chemie/4/handouts/hofmann.pdf | wayback=20111112021354 | text=Der Hofmannsche Zersetzungsapparat}} (PDF-Datei; 30 kB) |
* {{Webarchiv | url=http://www.schoenhacker.at/chemie/4/handouts/hofmann.pdf | wayback=20111112021354 | text=Der Hofmannsche Zersetzungsapparat}} (PDF-Datei; 30 kB) |
||
Version vom 2. März 2017, 01:36 Uhr
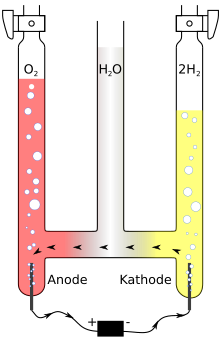
Der Hofmannsche Wasserzersetzungsapparat, Hofmannsche Zersetzungsapparat oder Wasserzersetzungsapparat nach Hofmann ist ein Gerät zur elektrolytischen Zerlegung von wässrigen Lösungen und wurde nach August Wilhelm Hofmann (1818–1892) benannt, der diesen Versuchsaufbau z. B. in seinem 1866 erschienenen Buch beschrieben hat.[1] Der Versuchsaufbau wurde auch als ein Voltameter benutzt.
Funktion
Er dient zur Demonstration der elektrolytischen Zersetzung beispielsweise von Wasser. In diesem Fall wird die komplette Apparatur meistens mit verdünnter Schwefelsäure gefüllt, da reines Wasser keine ausreichende elektrische Leitfähigkeit besitzt.[2] Nach dem Anlegen einer Gleichspannung an den Platinelektroden oder Kohleelektroden findet eine Gasentwicklung an Kathode und Anode statt.
Dabei wird das Wasser in seine beiden Bestandteile Sauerstoff und Wasserstoff zerlegt. Die entstehenden Gase sammeln sich in den beiden Messrohren und können mit Hilfe eines Hahns entnommen werden. An der Kathode werden die Oxoniumionen, welche durch Protolyse der zugesetzen Säure entstanden sind, zu Wasserstoff reduziert und an der Anode das Wasser zu Sauerstoff und zu Oxoniumionen oxidiert.
Kathodenreaktion:
Anodenreaktion:
Gesamtreaktion:
Das Verhältnis der Gasvolumina in den Schenkeln wird dabei 1 : 2 (Sauerstoff : Wasserstoff) betragen. Dieses Verhältnis kann allerdings nicht genau zustande kommen, da sich der Sauerstoff am Anfang besser im Wasser löst als Wasserstoff. Um dieses Problem zu umgehen, sollte der Versuch ein paar Minuten zuvor bei geöffneten Hähnen laufen.
Funktionsweise
Die positiv geladenen Oxoniumionen, die sich in der Nähe der negativ geladenen Elektrode, der Kathode, befinden, werden durch die negative Ladung angezogen und dort unter Wasserstofffreisetzung entladen (kathodische Reduktion). Im Bereich der positiv geladenen Elektrode, der Anode, werden dem Wasser Elektronen entzogen (anodische Oxidation). Die oxidierten Wasserteilchen sind instabil und zerfallen unter Freisetzung von Sauerstoff und Bildung von Oxoniumionen. Die Oxoniumionen müssen nicht durch die Lösung zur Kathode wandern, sie geben vielmehr ihre positive Ladung über eine Umorientierung der Wasserstoffbrückenbindungen durch die Lösung bis zur Kathode weiter:

Diese Form der elektrischen Leitung wird Protonenleitung genannt.[3]
Siehe auch
Literatur
- Eintrag zu Hofmannscher Zersetzungsapparat. In: Römpp Online. Georg Thieme Verlag
Weblinks
- Der Hofmannsche Zersetzungsapparat ( vom 12. November 2011 im Internet Archive) (PDF-Datei; 30 kB)
Einzelnachweise
- ↑ August Wilhelm Hofmann: Introduction to modern chemistry: experimental and theoretic; embodying… Walton and Maberly, 1866, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Kurzweil: Chemie. Springer Vieweg, Wiesbaden 2015, ISBN 978-3-658-08660-2, S. 198, doi:10.1007/978-3-658-08660-2.
- ↑ Skript des Schülerlabors Quantensprung der Helmholtz Gesellschaft: Wasserstoff und Brennstoffzelle (PDF; 8,3 MB).


