„Rucaparib“ – Versionsunterschied
AZ: Die Seite wurde neu angelegt: == Rucaparib == Rucaparib (Handelsname Rubraca®, Hersteller: Clovis Oncology) ist ein antitumoraler W… |
(kein Unterschied)
|
Version vom 4. Mai 2020, 20:39 Uhr
Rucaparib
Rucaparib (Handelsname Rubraca®, Hersteller: Clovis Oncology) ist ein antitumoraler Wirkstoff aus der Gruppe der PARP-Inhibitoren, der zur Behandlung des fortgeschrittenen, rezidivierten Ovarialkarzinoms (Eierstockkrebs) eingesetzt wird.[1]
Anwendungsgebiete (Indikationen):
Rucaparib wurde im Dezember 2016 von der US-amerikanischen Zulassungsbehörde (FDA) zur Behandlung des rezidivierten Ovarialkarzinoms mit BRCA-Mutationen für die USA zugelassen.[2] Die europäische Kommission (EK) erteilte im Mai 2018 eine Zulassung für Rucaparib in der Europäischen Union (EU) als Monotherapie zur Behandlung von erwachsenen Patientinnen mit platinsensitivem, rezidiviertem oder progressivem high-grade Ovarial-, Eileiter- oder Peritonealkarzinom mit BRCA-Mutationen (Keimbahn und/oder somatisch), die mit zwei oder mehr vorherigen platinbasierten Chemotherapielinien behandelt wurden und keine weitere platinhaltige Chemotherapie tolerieren.[1][3] Damit war Rucaparib der erste PARP-Inhibitor, der für eine Rezidivbehandlung von BRCA-mutierten Ovarialkarzinomen in der EU zugelassen wurde.
Im Januar 2019 erfolgte in der EU eine Zulassungserweiterung durch die EK für Rucaparib als Monotherapie zur Behandlung von erwachsenen Patientinnen mit platinsensitivem, rezidiviertem oder progressivem high-grade Ovarial-, Eileiter- oder primärem Peritonealkarzinom, die nach platinbasierter Chemotherapie in Remission sind (vollständig oder partiell).[1][3] Letztere Indikation ist unabhängig vom Vorliegen einer BRCA-Mutation. Auf dem deutschen Markt ist Rucaparib (Rubraca®) seit März 2019 erhältlich.
Art und Dauer der Anwendung:
Rucaparib ist in drei Dosisstärken erhältlich: 300 mg, 250 mg und 200 mg. Die zugelassene Anfangsdosis von Rucaparib beträgt 600 mg zweimal täglich, was einer Gesamttagesdosis von 1.200 mg entspricht. Die Tabletten werden morgens und abends unabhängig von den Mahlzeiten entsprechend den Angaben in der Fachinformation eingenommen.[1]
Unerwünschte Wirkungen:
Die häufigsten unerwünschten Nebenwirkungen, die bei Rucaparib behandelten Patientinnen auftraten, waren Übelkeit, Müdigkeit/Asthenie, Erbrechen, Anämie, Schmerzen des Abdomens, Dysgeusie, erhöhte ALT-Werte, erhöhte AST-Werte, verminderter Appetit, Diarrhoe, Thrombozytopenie und erhöhte Kreatininwerte. Die Nebenwirkungen waren mehrheitlich leicht bis mittelschwer (1. oder 2. Grades). Zu den häufigsten höhergradigen Nebenwirkungen (≥Grad 3) zählten Anämie (23%), erhöhte ALT-Werte (10%), Müdigkeit/Asthenie (10 %), Neutropenie (8%), Thrombozytopenie (6%) und Übelkeit (5 %). Mittelschwere bis schwere Nebenwirkungen (d.h. 3. oder 4. Grades nach CTCAE), wie Neutropenie, Anämie und Thrombozytopenie, können mit Dosisunterbrechungen und/ oder Dosisreduzierungen behandelt werden. Nebenwirkungen, die zum dauerhaften Absetzen führten, traten bei 10 % der Patientinnen auf.[1]
Wirkmechanismus:
Rucaparib blockiert die Aktivität von Poly-ADP-Ribose-Polymerasen (PARP) (PARP-1, -2 und -3), die zur Reparatur von DNA-Einzelstrangbrüchen benötigt werden. In Krebszellen, die Defekte in der Reparatur von DNA-Doppelstrangbrüchen aufweisen, wie z.B. vermittelt durch BRCA-Mutationen oder Defekten in anderen DNA-Reparaturwegen, führt die Hemmung von PARP zur Anhäufung von DNA-Doppelstrangbrüchen, wodurch die Zellen in den programmierten Zelltod (Apoptose) getrieben werden (synthetische Letalität).[4]
Klinische Studien:
Die Zulassung von Rucaparib als Rezidiv-Erhaltungstherapie erfolgte auf Basis der randomisierten doppelblinden Phase-III-Studie ARIEL3, in der die Wirksamkeit und Sicherheit im Vergleich zu Placebo bei 564 Patientinnen mit Ovarialkarzinom untersucht wurde, die ein komplettes oder partielles Ansprechen auf mindestens zwei vorherige platinbasierte Chemotherapien zeigten. ARIEL3 erreichte sowohl den primären Endpunkt – Verlängerung des vom Prüfarzt festgestellten progressionsfreien Überlebens (PFS) im Vergleich zu Placebo (Median 10,8 vs. 5,4 Monate) – als auch wichtigen sekundären Endpunkt – Verlängerung des PFS durch eine unabhängige radiologische Überprüfung (independent radiological review, IRR; Median 13,7 vs. 5,4 Monate) – und dies unabhängig vom BRCA-Status.[5] Patientinnen, die zu Studienbeginn ein partielles oder vollständiges Ansprechen auf die Chemotherapie zeigten, profitierten in gleichem Maße.[6]
Die Zulassung von Rucaparib als Rezidivmonotherapie ab der Drittlinie bei Patientinnen mit fortgeschrittenem epithelialem Ovarial-, Eileiter- oder primärem Peritonealkarzinom mit BRCA-Mutationen basiert auf den Ergebnissen der beiden einarmigen Phase-II-Studien ARIEL2 und Studie 10.[7]
Weitere Studien laufen, um die Wirksamkeit von Rucaparib beim Ovarialkarzinom und in anderen Indikationen zu untersuchen, unter anderem beim Prostatakarzinom [8][9]. Im Januar 2020 wurde für Rucaparib eine Zulassungserweiterung beim BRCA-mutierten, rezidivierten kastrationsresistenten Prostatakarzinom bei der FDA eingereicht und erhielt eine „priority review designation“.[10]
Leitlinien:
Die European Society for Medical Oncology (ESMO) und European Society of Gynaecologial Oncology (ESGO) hat auf Basis einer Konsensuskonferenz im April 2018 Rucaparib in die Behandlungsempfehlungen des Ovarialkarzinoms sowohl als Erhaltungstherapie nach einem Ansprechen auf eine platinbasierte Chemotherapie ab der Zweitlinie sowie ab der dritten Therapielinie auch als Monotherapie bei Patientinnen mit BRCA-Mutationen aufgenommen.[11]
Steckbrief:
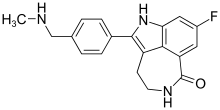
Strukturformel:
Allgemeines:
Handelsname: Rubraca®
Andere Namen: AG014699
Summenformel:
C19H18FN3O
Molare Masse:
323,371 g·mol−1
Externe Identifikatoren/Datenbank
CAS-Nummer: 283173-50-2
Arzneistoffangaben:[1]
ATC-Code: L01XX55
Wirkstoffklasse:
PARP-Inhibitoren
Pharmakokinetische Angaben:[1]
Bioverfügbarkeit:
Mittlere absolute orale Bioverfügbarkeit bei Einzeldosis von 12 – 120 mg = 36% (Tmax = 1,9 Stunden)
Metabolismus:
Leber (vorwiegend CYP2D6; in geringerem Ausmaß CYP1A2 and CYP3A4)
Mittlere Halbwertszeit (T1/2):
25,9 Stunden
Sicherheitshinweise:
Bitte die Befreiung von der Kennzeichnungspflicht für Arzneimittel, Medizinprodukte, Kosmetika, Lebensmittel und Futtermittel beachten.
- ↑ a b c d e f g Rucaparib (Rubraca) Fachinformation.
- ↑ Rucaparib, PM FDA vom 19. Dezember 2016, abgerufen am 15. April 2020.
- ↑ a b EMA overview of Rucaparib and why it is authorized in the EU. https://www.ema.europa.eu/en/documents/overview/rubraca-epar-medicine-overview_en.pdf
- ↑ LE Dockery, CC Gunderson, KN Moore: Rucaparib: the past, present, and future of a newly approved PARP inhibitor for ovarian cancer. In: OncoTargets and Therapy. Volume 10, Juni 2017, ISSN 1178-6930, S. 3029–3037, doi:10.2147/ott.s114714 (doi.org [abgerufen am 4. Mai 2020]).
- ↑ Coleman RL, et al. Lancet. 2017;390(10106):1949–1961.
- ↑ Ledermann JA, et al. ESMO 2019, Abstract 1001P.
- ↑ Oza AM, et al. Gynecol Oncol. 2017;147(2):267-275. doi: 10.1016/j.ygyno.2017.08.022.
- ↑ ClinicalTrial.gov. NCT02952534. A Study of Rucaparib in Patients With Metastatic Castration-resistant Prostate Cancer and Homologous Recombination Gene Deficiency (TRITON2)
- ↑ ClinicalTrial.gov. NCT02975934. A Study of Rucaparib Versus Physician's Choice of Therapy in Patients With Metastatic Castration-resistant Prostate Cancer and Homologous Recombination Gene Deficiency (TRITON3)
- ↑ Clovis Oncology’s Rubraca (rucaparib) granted FDA priority review for advanced prostate cancer [news release]. Boulder, Colorado: Clovis Oncology; January 15, 2020. https://bit.ly/2RfG4da. Abgerufen: 17. April 2020.
- ↑ Colombo N, et al. Int J Gynecol Cancer 2019;29:728–760.