Aluminiumnitrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
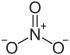
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aluminiumnitrat | ||||||||||||||||||
| Summenformel | Al(NO3)3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung ab 150 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Aluminiumnitrat ist eine chemische Verbindung, das Aluminiumsalz der Salpetersäure.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Aluminiumnitrat kann durch Auflösen von Aluminiumhydroxid in Salpetersäure erfolgen.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Es bildet farblose und zerfließliche rhombische Kristalle. Aluminiumnitrat ist sehr gut in Wasser löslich; die Lösung reagiert sauer.[1] Beim Auskristallisieren aus wässrigen Lösungen bildet sich das Nonahydrat Al(NO3)3·9 H2O. Beim Erhitzen gibt das Hydrat bei 73 °C das Kristallwasser wieder ab. Das Salz zeigt keinen Schmelzpunkt und zersetzt sich ab etwa 150 °C.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Der Stoff wurde früher zur Glühstrumpf-Herstellung eingesetzt. Bei der Herstellung von Kernbrennstäben dient das Nitrat als Extraktionsmittel für Uran. Weiterhin wird Aluminiumnitrat als Beize in der Färberei und zum Gerben von Leder verwendet.[2]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Aluminiumnitrat wirkt stark reizend auf die Schleimhäute der Augen und die Atemwege. Bei oraler Aufnahme können die aufgenommenen Nitrationen zu Schwindelgefühl, Kopfschmerzen sowie Schmerzen im Bauchbereich, blutigem Erbrechen, Durchfall, Erschlaffung der Gefäßmuskulatur und Verringerung der Herzfrequenz führen. Das Nitrat ist ein starkes Oxidationsmittel und wirkt daher brandfördernd.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Aluminiumnitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. April 2014.
- ↑ a b c d e f g Eintrag zu Aluminiumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9db8459a48d964bf7f88fb4159c82f09c14fe41d)

