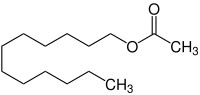
Dodecylacetat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dodecylacetat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H28O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 228,38 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,865 g·cm−3[1] | ||||||||||||||||||
| Siedepunkt |
150 °C (20 hPa)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dodecylacetat ist ein Carbonsäureester aus 1-Dodecanol und Essigsäure. Die Verbindung kommt natürlich vor allem als Pheromon vor und wird als Aromastoff verwendet.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Dodecylacetat ist eine wichtige Komponente im ätherischen Öl von Blumea eriantha[2] und von Backhousia bancroftii (Gattung Backhousia).[3] Außerdem kommt es zu etwa 3 % unter den flüchtigen Verbindungen in den Samen von Hibiscus abdelmoschus (Gattung Bisameibisch) vor.[4]
Im Alarmpheromon von Frankliniella occidentalis kommt es neben Decylacetat vor.[5] Im Pheromon von Trichoplusia ni macht es etwa 10 % aus.[6] In kleiner Menge kommt es im Pheromon der Saateule (Agrotis segetum)[7] und von Schizura concinna[8] vor, sowie in größerer Menge (12 %) in dem des Weidenbohrers (Cossus cossus)[9] vor. Der Hummelart Bombus norvegicus dient es als Repellent bzw. Allomon.[10] Den Arten Formica pergandei und Formica subintegra[11] dient es ebenfalls als Allomon.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Dodecylacetat kann durch Veresterung von Essigsäure mit 1-Dodecanol hergestellt werden.[12]
Verwendung
[Bearbeiten | Quelltext bearbeiten]In der EU ist Dodecylacetat unter der FL-Nummer 09.010 als Aromastoff für Lebensmittel allgemein zugelassen.[13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Datenblatt Laurylacetat bei Sigma-Aldrich, abgerufen am 29. August 2023 (PDF).
- ↑ Giovanni Benelli, Marimuthu Govindarajan, Mohan Rajeswary, Sengamalai Senthilmurugan, Periasamy Vijayan, Naiyf S. Alharbi, Shine Kadaikunnan, Jamal M. Khaled: Larvicidal activity of Blumea eriantha essential oil and its components against six mosquito species, including Zika virus vectors: the promising potential of (4E,6Z)-allo-ocimene, carvotanacetone and dodecyl acetate. In: Parasitology Research. Band 116, Nr. 4, April 2017, S. 1175–1188, doi:10.1007/s00436-017-5395-0.
- ↑ Joseph J. Brophy, Robert J. Goldsack, Christopher J. R. Fookes, Paul I. Forster: Leaf Oils of the Genus Backhousia (Myrtaceae). In: Journal of Essential Oil Research. Band 7, Nr. 3, Mai 1995, S. 237–254, doi:10.1080/10412905.1995.9698514.
- ↑ Michael R. Pollard, Shahin Jamil-Panah, Thomas Y. Nee: On the Biosynthesis of Fragrance Compounds in Ambrette (Hibiscus abelmoschus) Seeds. In: The Metabolism, Structure, and Function of Plant Lipids. Springer New York, Boston, MA 1987, ISBN 978-1-4684-5265-5, S. 139–142, doi:10.1007/978-1-4684-5263-1_24.
- ↑ C. R. Teerling, H. D. Pierce, J. H. Borden, D. R. Gillespie: Identification and bioactivity of alarm pheromone in the western flower thrips,Frankliniella occidentalis. In: Journal of Chemical Ecology. Band 19, Nr. 4, April 1993, S. 681–697, doi:10.1007/BF00985001.
- ↑ Louis B. Bjostad, Lyle K. Gaston, Lesly L. Noble, J. Harvey Moyer, H. H. Shorey: Dodecyl acetate, a second pheromone component of the cabbage looper moth,Trichoplusia ni. In: Journal of Chemical Ecology. Band 6, Nr. 4, Juli 1980, S. 727–734, doi:10.1007/BF00990397.
- ↑ Christer Löfstedt, Jan N. C. Van Der Pers, Jan Lofqvist, Boel S. Lanne, Monica Appelgren, Gunnar Bergström, Bernt Thelin: Sex pheromone components of the turnip moth,Agrotis segetum: Chemical identification, electrophysiological evaluation and behavioral activity. In: Journal of Chemical Ecology. Band 8, Nr. 10, Oktober 1982, S. 1305–1321, doi:10.1007/BF00987764.
- ↑ J. Weatherston, J. E. Percy, L. M. MacDonald, J. A. MacDonald: Morphology of the prothoracic defensive gland ofSchizura concinna (J.E. Smith) (Lepidoptera:Notodontidae) and the nature of its secretion. In: Journal of Chemical Ecology. Band 5, Nr. 2, März 1979, S. 165–177, doi:10.1007/BF00988232.
- ↑ A. Capizzi, C. Tonini, E. Arsura, G. Guglielmetti, P. Massardo, P. Piccardi: Sex pheromone components of the European goat moth,Cossus cossus. In: Journal of Chemical Ecology. Band 9, Nr. 2, Februar 1983, S. 191–200, doi:10.1007/BF00988036.
- ↑ B. O. Zimma, M. Ayasse, J. Tengö, F. Ibarra, C. Schulz, W. Francke: Do social parasitic bumblebees use chemical weapons? (Hymenoptera, Apidae). In: Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology. Band 189, Nr. 10, 1. Oktober 2003, S. 769–775, doi:10.1007/s00359-003-0451-x.
- ↑ F. E. Regnier, E. O. Wilson: Chemical Communication and "Propaganda" in Slave-Maker Ants. In: Science. Band 172, Nr. 3980, 16. April 1971, S. 267–269, doi:10.1126/science.172.3980.267.
- ↑ You Tong Yu, Li Na Liu, Xiao Li Zhu, Xiang Zheng Kong: Microencapsulation of dodecyl acetate by complex coacervation of whey protein with acacia gum and its release behavior. In: Chinese Chemical Letters. Band 23, Nr. 7, Juli 2012, S. 847–850, doi:10.1016/j.cclet.2012.05.006.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 29. August 2023.