Schreiadler
| Schreiadler | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Schreiadler (Clanga pomarina) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Clanga pomarina | ||||||||||||
| (Brehm, 1831) |
Der Schreiadler (Clanga pomarina, Syn.: Aquila pomarina)[1], veraltet auch Pommernadler genannt, ist eine Vogelart aus der Familie der Habichtartigen (Accipitridae). Dieser vergleichsweise kleine Vertreter der Unterfamilie der Aquilinae hat ein relativ kleines Verbreitungsgebiet im Westen der Paläarktis; die westliche Arealgrenze verläuft durch den Osten Deutschlands. Das Epitheton pomarina bezieht sich auf die Herkunft des Holotypus aus der ehemaligen preußischen Provinz Pommern.[2] Die Art bewohnt naturnahe Wälder mit angrenzenden extensiv genutzten Flächen und ernährt sich vor allem von kleinen Wirbeltieren, aber auch von Insekten und anderen Wirbellosen sowie Aas.
Die Art ist vor allem durch ihre besondere Brutbiologie bekannt, den Kainismus. Meist werden zwei Eier gelegt; das zuerst geschlüpfte Junge tötet jedoch grundsätzlich das jüngere Geschwister, so dass außer in seltenen Ausnahmefällen immer nur ein Jungvogel ausfliegt.
Der Schreiadler ist ein Zugvogel, er überwintert im südlichen Afrika. Der Weltbestand ist ungefährdet, der deutsche Bestand ist jedoch rückläufig und gilt laut Roter Liste als vom Aussterben bedroht.[3]
Beschreibung
[Bearbeiten | Quelltext bearbeiten]

Schreiadler gehören zu den kleinsten Vertretern der Unterfamilie der Aquilinae. Sie erreichen eine Körperlänge von 55 bis 67 cm und eine Flügelspannweite von 1,46 bis 1,68 m und sind damit immer noch deutlich größer als beispielsweise ein Mäusebussard. Der Geschlechtsdimorphismus ist bezüglich Größe und Gewicht recht deutlich ausgeprägt, Männchen erreichen im Mittel etwa 85 % der Größe der Weibchen. Männchen wiegen 1,0 bis 1,4 kg und haben eine Flügellänge von 446 bis 478 mm, Weibchen erreichen ein Gewicht von 1,3 bis 2,2 kg und eine Flügellänge von 493 bis 508 mm.[4] Wie bei allen Vertretern der Gattung Clanga und der nahe verwandten Gattung Aquila sind die Handschwingenspitzen stark gefingert, und die Beine sind bis zu den Zehen befiedert. Im Flug wirken die Flügel relativ kurz und auffallend breit, der Schwanz ist an den Außenkanten deutlich gerundet.
Adulte Vögel sind insgesamt braun gefärbt. Der Rumpf, der Kopf sowie die Oberflügel- und die Unterflügeldecken sind warm hellbraun, teilweise heller gelblich-braun. Sie bilden vor allem beim fliegenden Vogel einen deutlichen Kontrast zu den einfarbig dunkelgrau-braunen Schwung- und Steuerfedern. Die Basen der inneren Handschwingen sind weißlich und bilden auf dem Oberflügel ein nicht sehr auffallendes weißes Feld, die Oberschwanzdecken sind breit weiß gerandet. Die Iris ist orangegelb, die Wachshaut und die Zehen haben eine gelbe Färbung. Die Schnabelbasis ist grau gegen den im Übrigen schwarzen Schnabel abgesetzt.
Im Jugendkleid sind Kopf, Rumpf und Flügeldecken insgesamt dunkler als bei den Altvögeln. Die großen Hand- und Armdecken sind weiß gerandet und bilden ein beim fliegenden Vogel gut sichtbares helles Band auf dem Oberflügel. Häufig sind auch die mittleren Flügeldecken schwach weiß gerandet. Die Schwingen und die Steuerfedern zeigen eine dichte dunkle Querbänderung; die inneren Handschwingen, die Armschwingen und die Steuerfedern sind ebenfalls weiß gerandet. Im Nacken zeigen junge Schreiadler einen rostgelben diffusen Fleck. Die Iris ist braun. Die Jungvögel sind nach drei Jahren ausgefärbt.[5]
Lautäußerungen
[Bearbeiten | Quelltext bearbeiten]Der bis zum Schlupf der Jungvögel häufig zu hörende Erregungsruf ist ein kräftiges „tjück“, das auch mit „jück“ oder „jüb“ wiedergegeben wird und meist zwei- bis dreimal hintereinander ertönt. Beim Balzflug ruft das Männchen „wiiik“, der Ruf ähnelt einem langen Pfiff. Die Rufe der Jungvögel ähneln bereits im Alter von etwa 20 Tagen weitgehend denen der adulten Tiere.
Verbreitung
[Bearbeiten | Quelltext bearbeiten]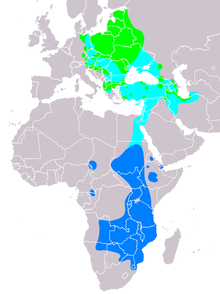
Der Schreiadler hat ein relativ kleines, stark zergliedertes Verbreitungsgebiet im Westen der Paläarktis. Im Norden des Artareals verläuft die westliche Verbreitungsgrenze durch Nordostdeutschland, nach Osten reicht das Vorkommen bis in den Westen Russlands, die genaue östliche Verbreitungsgrenze ist bisher nicht bekannt. Im Süden liegen die westlichsten, isolierten Vorkommen in Slowenien und Kroatien; weiter nach Osten folgt ein relativ geschlossenes Verbreitungsgebiet, das von Griechenland und dem Osten des Balkans über die Türkei bis in die Kaspische Senke im Norden des Iran reicht. Im Norden reicht die Verbreitung bis zur russischen Ostseeküste, im Süden bis Mittelgriechenland, bis zum Süden der Türkei und bis in den oben erwähnten Norden des Iran.
In Deutschland sind die Osthälfte Mecklenburg-Vorpommerns[6] und ein etwa 3600 km² großes Gebiet im Nordosten Brandenburgs (Landkreise Barnim, Uckermark und Oberhavel) besiedelt.[7] Ein isolierter westlicher Vorposten befand sich bis 2011 in Sachsen-Anhalt im Hakel Höhenzug sowie im Steckby-Lödderitzer Forst. In Sachsen-Anhalt ist der Schreiadler seit 2012 ausgestorben.
Systematik
[Bearbeiten | Quelltext bearbeiten]Bis vor einigen Jahren wurde für den Schreiadler neben der Nominatform eine zweite, nur auf den Indischen Subkontinent beschränkte Unterart Aquila pomarina hastata beschrieben. Diese Unterart wurde 2002 aufgrund morphologischer, anatomischer und brutbiologischer Merkmale sowie aufgrund von Verhaltensmerkmalen als eigene Art Aquila hastata (neuerdings Clanga hastata) abgegrenzt,[8][1] die 2009 den deutschen Trivialnamen Gangesadler[9] erhielt. Molekulargenetische Untersuchungen haben diesen Artstatus bestätigt, demnach bildet der Gangesadler das Schwestertaxon des Artenpaares Schreiadler und Schelladler. Der Schreiadler ist demnach also mit dem Schelladler enger verwandt als mit dem Gangesadler.[10]
Eine weitere molekulargenetische Untersuchung ergab, dass Schreiadler und Schelladler reproduktiv nicht vollständig voneinander isoliert sind, wobei der Genfluss jedoch offenbar nur in Richtung Schreiadler erfolgt.[11] Etwa 8 % der untersuchten phänotypischen Schreiadler wiesen in der nur über die mütterliche Linie weitergegebenen mitochondrialen DNA (mtDNA) Haplotypen des Schelladlers auf. Untersuchungen der Zellkern-DNA ergaben jedoch, dass die Schreiadler mit Schelladlerhaplotypen in der mtDNA genetisch zwischen den Stichproben von Individuen beider Arten liegen, bei denen die Haplotypen der mtDNA mit den Phänotypen übereinstimmten. Das deutet darauf hin, dass diese Schreiadler mit Schelladler-mtDNA entweder direkte Nachkommen eines Mischpaares aus Schelladlerweibchen und Schreiadlermännchen (F1-Hybriden) oder Nachkommen eines weiblichen Hybriden mit einem Schreiadlermännchen sind.
Die Ergebnisse lassen vermuten, dass Mischpaare überwiegend aus Schelladlerweibchen und Schreiadlermännchen bestehen und dass die Hybridweibchen ihrerseits wiederum mit Schreiadlermännchen brüten. Die erste Vermutung stimmt mit den bisher vorliegenden Beobachtungen von Mischpaaren überein; die zweite Vermutung ist plausibel, da nur so der Größenunterschied zwischen den Paarpartnern gewährleistet ist. Der relativ hohe Prozentsatz von Schreiadlern mit Schelladlerhaplotypen weist schließlich darauf hin, dass zumindest einzelne Schelladler regelmäßig weit westlich des geschlossenen Verbreitungsgebietes der Art Mischpaare mit Schreiadlern bilden. Dass dies tatsächlich so ist, wurde unter anderem durch die Entdeckung eines Mischpaares in Mecklenburg-Vorpommern im Jahr 2003 bestätigt, weiter östlich sind einzelne Mischpaare schon seit Anfang der 1990er-Jahre bekannt.
Lebensraum
[Bearbeiten | Quelltext bearbeiten]Schreiadler bewohnen naturnahe Wälder mit angrenzenden offenen, nahrungsreichen Flächen. Im Norden des Verbreitungsgebietes (Deutschland, Polen, Baltikum, Russland) werden extensiv genutzte, feuchte Niederungen mit Laub- und Mischwäldern und angrenzenden Feuchtwiesen und Mooren besiedelt. Etwa ab der Slowakei und Ungarn und weiter südlich liegt der Schwerpunkt der Vorkommen jedoch im locker mit Laubwald bestockten und mit Wiesen durchsetzten, meist trockenen Hügel- und Bergland. So werden z. B. in Rumänien Höhenlagen zwischen 300 m und 1600 m besiedelt, auch in Bulgarien kommt die Art bis in 1400 m Höhe vor. Im Bereich der südlichen Verbreitungsgrenze im Wald von Dadia im Nordosten Griechenlands bewohnt der Schreiadler schließlich fast ausschließlich trockene Kiefernwälder in Höhen zwischen 100 und 300 m, Laubwälder werden dort gemieden.[12]
Raumnutzung und Siedlungsdichte
[Bearbeiten | Quelltext bearbeiten]In Mecklenburg-Vorpommern und in Lettland wurden 1994 bis 1997 Untersuchungen zur Größe des Aktionsraumes während der Brutzeit mit Hilfe von Bodentelemetriesendern durchgeführt.[13] Männchen in Mecklenburg-Vorpommern hatten einen Aktionsraum von im Mittel 27,1 km² (22,2–33,9 km²), die Aktionsräume von Männchen in Lettland waren mit im Mittel 11,4 km² (6,7–15,5 km²) erheblich kleiner. Der Unterschied wurde in erster Linie auf den größeren Anteil nahrungsreicher Habitate (vor allem Grünland) im Nestumfeld der lettischen Reviere zurückgeführt.
Bei vier in den Jahren 2004–2006 mit GPS-Satellitensendern versehenen Männchen in Brandenburg und Mecklenburg-Vorpommern waren die Aktionsräume während der Brutzeit zwischen 32,8 und 54,4 km² groß; diese Vögel wurden jedoch erst ab Mitte Juli besendert, so dass die Aktionsräume vermutlich nicht vollständig erfasst wurden. Bei einem fünften Männchen, das 2005 ab Ende Juni und 2006 ab Anfang Mai untersucht wurde, war der Aktionsraum 2005 93,8 km² groß, 2006 sogar 172,3 km².[14]
Die Siedlungsdichte des Schreiadlers schwankt in Abhängigkeit von landschaftlichen Gegebenheiten erheblich. In Polen wurden bei großflächigen Untersuchungen Siedlungsdichten zwischen 1,5 und 10,8 Brutpaaren (BP) pro 100 km² ermittelt, der höchste Wert wurde im Białowieża-Nationalpark festgestellt.[15] Die bekannten Siedlungsdichtewerte aus anderen Teilen des Verbreitungsgebietes liegen innerhalb dieses Wertebereiches.[16]
Jagdweise und Nahrung
[Bearbeiten | Quelltext bearbeiten]Der Schreiadler nutzt zur Jagd auf bodenbewohnende Tiere im Wesentlichen drei Methoden: Die Jagd zu Fuß, die Ansitzjagd sowie den Suchflug. Schreiadler sind für ihre Fußjagd bekannt, dabei laufen sie vor allem auf Wiesen oder abgeernteten Äckern ähnlich wie der Weißstorch größere Strecken. Zur Ansitzjagd werden niedrige Warten genutzt, zum Beispiel Heuhaufen, Zaunpfähle oder Bäume. Der Suchflug findet in niedriger Höhe statt, dabei kreist der Adler über geeigneten Bereichen und steht häufig gegen den Wind in der Luft (siehe Foto ganz oben (Taxobox)).
Die Nahrung des Schreiadlers umfasst ein breites Spektrum bodenbewohnender kleiner Wirbeltiere bis zur Größe junger Feldhasen sowie Wirbellose und Aas. Eine Ermittlung der tatsächlichen Nahrungszusammensetzung ist aufgrund der sehr unterschiedlichen Nachweisbarkeit der einzelnen Beutetaxa sehr schwierig. Auch ein Vergleich verschiedener Studien zur Ernährung ist wegen der oft sehr unterschiedlichen Untersuchungsmethoden problematisch.
Die Nestlinge werden offenbar ausschließlich mit Wirbeltieren gefüttert, dabei können je nach Region Kleinsäuger, Amphibien oder Reptilien den Hauptteil der Beute ausmachen. Bei einem mit einer Videoanlage am Nest kontinuierlich beobachteten Paar in Mecklenburg-Vorpommern bestand die zum Nest gebrachte Nahrung zu über 90 % aus Kleinsäugern, die übrige Beute setzte sich aus Amphibien, Eidechsen und Singvögeln zusammen.[17] Bei Nestkontrollen im nördlichen Belarus wurden hingegen als häufigste Beutetiergruppe Amphibien mit 62,0 % festgestellt, die beiden häufigsten Arten waren der Grasfrosch mit 39,0 % und der Moorfrosch mit 17,5 % aller Beutetiere. Säuger waren mit insgesamt 29,1 %, Vögel mit 5,6 % und Reptilien mit 3,3 % im Beutespektrum vertreten.[18]
In den bereits relativ trockenen Mittelgebirgen im Norden Ungarns mit angrenzenden landwirtschaftlich genutzten Flächen wurden bei Aufsammlungen von Beuteresten am Horst Kleinsäuger mit 79,7 % aller Beutetiere als dominierende Wirbeltiergruppe festgestellt, 50,0 % der Beutetiere waren dort Feldmäuse, an zweiter Stelle folgten Feldhamster mit 16,4 %. Vögel bildeten 20,3 % der Beute, am häufigsten waren Jagdfasane mit 4,7 % und Feldlerchen mit 2,3 % aller Beutetiere. Hingegen waren dort Amphibien (nur Echte Frösche) mit nur 1,6 % im Beutespektrum vertreten, Reptilien fehlten völlig.[19]
Im Rahmen einer Studie im weitgehend trockenen Wald von Dadia in Griechenland wurden nur Gewölle untersucht. Hauptbeute waren dort Reptilien, die in 80,2 % aller Gewölle gefunden wurden, ansonsten konnten nur Säuger und Insekten nachgewiesen werden. Häufigstes Beutetier war die Ringelnatter (Nachweis in 41,6 % aller Gewölle), danach folgte die Eidechsennatter (in 20,8 % aller Gewölle) und Eidechsen der Gattung Lacerta (in 19,8 % aller Gewölle). Bei Direktbeobachtungen konnten jedoch auch zahlreiche Frösche als Beute festgestellt werden, die in Gewöllen offenbar kaum nachweisbar sind.[12] Das Nahrungsspektrum im Winterquartier ist offenbar ähnlich breit wie im Brutgebiet, wobei die Art hier aber offenbar vor allem das kurzfristig oft stark wechselnde Nahrungsangebot von Termiten, Heuschrecken und Blutschnabelwebern sehr intensiv nutzt. So wurden im Kruger-Nationalpark in Südafrika im Februar 1997 in einer etwa 16 km² großen Kolonie des Blutschnabelwebers etwa 1000 Schreiadler bei der Plünderung von Nestern beobachtet.[20]
Fortpflanzung
[Bearbeiten | Quelltext bearbeiten]Balz und Nestbau
[Bearbeiten | Quelltext bearbeiten]
Die Balz beginnt meist unmittelbar nach der Ankunft am Brutplatz. Das Männchen zeigt dabei ausdauernde Wellenflüge, wobei es sich am höchsten Punkte einer „Welle“ mit angelegten Flügeln abwärtsbewegt, um dann mit dem gewonnenen Schwung wieder zur nächsten Welle aufzusteigen. Außerdem zeigt es einen Flatterflug, bei dem es die etwa waagerecht gehaltenen Flügel schnell auf- und abschlägt. Kopulationen finden meist im Anschluss an diese Balzflüge auf einer freien Sitzwarte in Horstnähe statt.
Die Nester (Horste) werden auf Bäumen im Wald und meist in dessen Randzone errichtet und überwiegend selbst gebaut, nur selten werden Nester anderer Vogelarten überbaut. Die gewählte Baumart richtet sich nach dem vorhandenen Angebot. Die Nester können je nach natürlichen Gegebenheiten und Alter sehr unterschiedliche Größen haben, so wurden bei einer Studie in Litauen Nestdurchmesser zwischen 60 und 126 cm (Mittelwert 88,5 cm) und Nesthöhen zwischen 15 und 120 cm (Mittelwert 60,4 cm) festgestellt.[21] Die Nestmulde wird mit grünen Zweigen ausgelegt.
Gelege und Aufzucht der Jungvögel
[Bearbeiten | Quelltext bearbeiten]
Die Eiablage erfolgt in Mitteleuropa selten bereits Ende April, meist jedoch Anfang bis Mitte Mai. Die Gelege bestehen meist aus zwei Eiern, seltener aus nur einem und sehr selten aus drei Eiern. Beispielsweise wurden in Litauen bei 37 Gelegen 8-mal 1 Ei, 28-mal 2 Eier (76 %) und 1-mal 3 Eier gefunden[21], in Ungarn bei 72 Gelegen 20-mal 1 Ei, 51-mal 2 Eier (71 %) und 1-mal 3 Eier.[19] Die Eier sind auf weißem Grund bräunlich oder violett gefleckt. Sie wiegen 72–87 g; vor 1921 im damaligen Deutschland gesammelte Eier maßen im Mittel 62,9 × 50,7 mm.[22]

Ab dem ersten Ei wird gebrütet, der Legeabstand beträgt 3 bis 4 Tage. Die Brutdauer beträgt 38 bis 41 Tage, wobei überwiegend das Weibchen brütet. Falls zwei Küken schlüpfen, wird das zweite Küken vom zuerst geschlüpften Geschwister durch Schnabelhiebe getötet, so dass außer in seltenen Ausnahmefällen immer nur ein Jungvogel ausfliegt. Die Geschwistertötung, Adelphophagie, ist angeboren und erfolgt unabhängig vom Ernährungszustand der Jungvögel, dieses Verhalten wird daher auch als „obligatorischer Kainismus“ bezeichnet.[23] Bei einer per Videoanlage ständig beobachteten Brut in Mecklenburg-Vorpommern begannen die Attacken des zuerst geschlüpften Kükens bereits am Tag des Schlüpfens des zweiten Kükens und endeten nach 2,5 Tagen mit dessen Tod. Der tote Jungvogel wurde am folgenden Tag verfüttert.[17]
Ende Juli bis Mitte August fliegen die Jungvögel aus. Bis zu ihrem Abzug um Mitte September werden sie von den Eltern gefüttert und jagen nur ausnahmsweise selbständig.
Geschlechtsreife und Lebensalter
[Bearbeiten | Quelltext bearbeiten]Schreiadler sind im dritten Lebensjahr ausgefärbt und dann vermutlich auch geschlechtsreif. Über das Durchschnittsalter freilebender Schreiadler ist nichts bekannt; das durch Beringung nachgewiesene Maximalalter beträgt 26 Jahre.[24]
Wanderungen
[Bearbeiten | Quelltext bearbeiten]Schreiadler sind Langstreckenzieher, sie überwintern im südlichen Afrika. Die Art hält sich im Brutgebiet etwa von Mitte April bis Mitte September auf, also etwa 5 Monate lang. Schreiadler sind als Thermiksegler ausgesprochene Schmalfrontzieher, das Mittelmeer wird im Osten umflogen. Das Zuggeschehen konzentriert sich daher auf die bekannten Schwerpunkte des Vogelzuges in Südosteuropa und im Nahen Osten. Fast die gesamte Population passiert im Herbst Israel auf dem Weg nach Afrika.
Herbstzug
[Bearbeiten | Quelltext bearbeiten]Der größte Teil der europäischen Population zieht nach Südosten über den Bosporus; zwischen 1966 und 1972 wurden dort maximal 18.900 Durchzügler pro Herbst gezählt.[25] Der weitere Zug verläuft dann entlang der östlichen Mittelmeerküste über die östliche Türkei, Syrien, den Libanon und Israel nach Afrika. Ein Teil der osteuropäischen Schreiadler zieht auch an der Ostküste des Schwarzen Meeres entlang nach Süden, dann durch den Osten der Türkei und ebenfalls über Syrien, den Libanon und Israel nach Afrika.
In Kefar Kassem nördlich von Tel Aviv wurden von 1982 bis 1987 im Herbst im Mittel 104.000 Durchzügler erfasst,[26] in den weiter nördlich gelegenen „Northern Valleys“ wurden von 1988 bis 1990 im Mittel 71.500 Durchzügler pro Herbst gezählt.[27] Bei Kefar Kassem beginnt der Zug frühestens Ende August oder Mitte September. Die Hauptmasse zieht zwischen dem 20. September und dem 5. Oktober, der Median des Wegzuges liegt zwischen dem 26. und dem 30. September. Mitte Oktober endet der Zug.[26]
Der weitere Zug durch Afrika konnte erst ab Mitte der 1990er Jahre durch die Satellitentelemetrie geklärt werden. So wurden 1994 vier adulte Männchen in Deutschland und der Slowakei gefangen und mit Satellitensendern versehen. Sie verließen zwischen dem 1. und dem 21. September die Brutgebiete und überquerten zwischen dem 14. September und dem 9. Oktober den Bosporus und Israel. Südlich von Sues flogen alle Vögel fast gerade nach Süden bis zum Tanganjika-See in Tansania, wo sie Ende Oktober eintrafen. Von dort zogen die Vögel in verschiedene südliche Richtungen in die Winterquartiere.[28] Seit 2014 lässt sich die Reise mehrerer Schreiadler live im Internet verfolgen.[29]
Winterquartier
[Bearbeiten | Quelltext bearbeiten]Der Schreiadler überwintert im südlichen Afrika etwa vom mittleren Tansania nach Süden bis in den Nordosten Südafrikas. Der größte Teil der Population hält sich während des Winters in einem Kerngebiet auf, das die Länder Simbabwe, Sambia, Mosambik, den Norden Namibias sowie den o. g. Nordosten Südafrikas umfasst.
Die Winterhabitate bestehen in erster Linie aus feuchten, offenen oder nur gering bewaldeten Savannen. Soweit bekannt, folgen Schreiadler dort den Regenfronten, die jeweils für ein gutes Nahrungsangebot sorgen. Auch in den Winterquartieren ziehen Schreiadler daher großräumig umher. Das Winterareal eines mit einem Satellitensender versehenen deutschen Schreiadlers umfasste ein ca. 25.000 km² großes Gebiet in Sambia, ein über mehrere Jahre untersuchter slowakischer Adler suchte in jedem Winter andere Gebiete in den Ländern Simbabwe, Mosambik und Südafrika auf und legte dabei in zwei Wintern Entfernungen von mindestens 2269 km bzw. 1919 km zurück.[30]
Frühjahrszug
[Bearbeiten | Quelltext bearbeiten]Der Abzug aus dem Winterquartier ist bisher nur von drei mit Satellitensendern ausgerüsteten Tieren bekannt, diese begannen den Heimzug am 26. Februar, am 28. Februar sowie am 2. März und 19. Februar (die letzten beiden Daten betrafen dasselbe Individuum in aufeinanderfolgenden Jahren). Zwei dieser Adler trafen am 22. April in der Slowakei bzw. am 19. April in Deutschland wieder am Brutplatz ein.[28][30]
In Israel wird der Frühjahrszug kaum registriert, da der Hauptdurchzug östlich und nördlich der bekannten Beobachtungspunkte verläuft. In Eilat wurden in den Jahren 1983, 1985 und 1986 zwischen 40 und 74 Heimzügler registriert. Der Heimzug begann dort mit einzelnen Individuen Mitte Februar, erreichte Ende März bis Anfang April seinen Höhepunkt und war bis zum 10. Mai beendet.[31] In den mitteleuropäischen Brutgebieten treffen die Vögel ausnahmsweise schon Ende März, meist aber in der ersten Aprilhälfte am Brutplatz ein, die Ankunftstermine der beiden oben genannten Adler waren demnach vergleichsweise recht spät.
Bestand und Gefährdung
[Bearbeiten | Quelltext bearbeiten]Einigermaßen zuverlässige Schätzungen zur Größe des Weltbestandes waren erst Ende der 1980er Jahre möglich, als erstmals die Anzahl der Herbstzieher über Israel recht vollständig erfasst wurde. In der Folgezeit wurde der Brutbestand für eine Reihe von Ländern zum Teil erheblich nach oben korrigiert. Meyburg[32] schätzte den Weltbestand basierend auf etwa 75.000 in Israel durchziehenden Individuen für Mitte der 1990er Jahre auf etwa 20.000 Brutpaare (BP), Mebs und Schmidt[33] kamen für Anfang des 21. Jahrhunderts auf etwa 15.000 BP. Der relativ große Unterschied ist vor allem auf die sehr unterschiedlichen Einschätzungen des Bestandes einzelner schlecht untersuchter Länder zurückzuführen, so schätzt Meyburg den Bestand der Türkei auf etwa 3000 BP; Mebs und Schmidt geben für dieses Land nur 80 bis 120 BP an. Die größten Bestände haben nach Mebs und Schmidt Belarus mit 3200 bis 3800 BP, Rumänien mit 2500–2800 BP, Lettland mit 2000 bis 2800 BP und Polen mit 1700–1900 BP; gegenüber den Schätzungen von Meyburg wurden vor allem die Bestandsangaben für die baltischen Staaten aufgrund neuerer Untersuchungen nochmals etwa verdoppelt. Der Weltbestand gilt laut IUCN als ungefährdet („least concern“).
Das Komitee gegen den Vogelmord e. V. geht davon aus, dass im Libanon jedes Jahr etwa 5000 Schreiadler durch Wilderer getötet werden.[34]
Am westlichen Arealrand in Deutschland sind Verbreitung und Bestand jedoch seit mindestens 1800 stark zurückgegangen, die Westgrenze der Verbreitung hat sich erheblich nach Osten verschoben. Um 1800 umfasste das besiedelte Areal auf dem Gebiet des heutigen Deutschlands eine Fläche von 83.000 km² und schloss Teile von Schleswig-Holstein und Niedersachsen mit ein (vgl. Abschnitt Verbreitung). Im Jahr 2004 umfasste das besiedelte Areal in Deutschland noch eine Fläche von rund 10.000 km². Wesentlichster Grund für den starken Rückgang war die starke Verfolgung durch den Menschen. Trotz fehlender Verfolgung in Deutschland geht der Bestand heute weiterhin zurück, als Hauptursache dafür gilt heute die Zerstörung des Lebensraumes durch die Intensivierung von Land- und Forstwirtschaft.[7] 2013 brüteten 91 Paare in Deutschland. Davon entfielen 68 auf Mecklenburg-Vorpommern, wo es zudem weitere 19 Revierpaare gab, und 23 auf Brandenburg.[35] In Sachsen-Anhalt brütet die Art seit 2012 nicht mehr. 2003 brüteten in Deutschland noch etwa 130 Paare. In der Roten Liste von Deutschland steht die Art heute in der Kategorie 1 (vom Aussterben bedroht).
Der Schreiadler ist eine Art des Anhangs I der EU-Vogelschutzrichtlinie (79/409/EWG[36] bzw. 2009/147/EG[37]), für die Vogelschutzgebiete auszuweisen sind.
Sonstiges
[Bearbeiten | Quelltext bearbeiten]- Der Schreiadler. Kleiner Adler mit großen Problemen. Eine Ausstellung der Deutschen Wildtier Stiftung im Ostpreußischen Landesmuseum, Lüneburg (10. September bis 30. Oktober 2016)[38]
Quellen
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Meyburg, B.U., Boesman, P., Marks, J.S. & Kirwan, G.M. (2017). Lesser Spotted Eagle (Clanga pomarina). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (abgerufen unter [1] am 16. Januar 2017).
- ↑ Viktor Wember: Die Namen der Vögel Europas – Bedeutung der deutschen und wissenschaftlichen Namen, Aula Verlag, Wiebelsheim 2007, ISBN 3-89104-709-6
- ↑ Torsten Ryslavy, Hans-Günther Bauer, Bettina Gerlach, Ommo Hüppop, Jasmina Stahmer, Peter Südbeck & Christoph Sudfeldt: Rote Liste der Brutvögel Deutschlands, 6. Fassung. In: Deutscher Rat für Vogelschutz (Hrsg.): Berichte zum Vogelschutz. Band 57, 30. September 2020.
- ↑ J. Ferguson-Lees, D. A. Christie: Raptors of the World. Christopher Helm, London 2001, ISBN 0-7136-8026-1: S. 727
- ↑ D. Forsman: The Raptors of Europe and the Middle East – A Handbook of Field Identification. T & A D Poyser, London 1999: S. 316–331
- ↑ W. Scheller: Schreiadler – Aquila pomarina. In: W. Eichstädt, W. Scheller, D. Sellin, W. Starke, K. D. Stegemann: Atlas der Brutvögel in Mecklenburg-Vorpommern. Verlag Steffen, Friedland 2006, ISBN 3-937669-66-3: S. 126–127
- ↑ a b B.-U. Meyburg, T. Langgemach, K. Graszynski & J. Böhner (2004): The Situation of the Lesser Spotted Eagle Aquila pomarina in Germany: The need for an Action Plan and active Conservation. In: R. D. Chancellor & B.-U. Meyburg (eds.): Raptors Worldwide. Budapest: WWGBP & MME, 2004: S. 601–613 Volltext als pdf
- ↑ S. J. Parry, W. S. Clark, V. Prakash: On the taxonomic status of the Indian Spotted Eagle Aquila hastata. Ibis 144, Heft 4, 2002: S. 665–675. doi:10.1046/j.1474-919X.2002.00109.x.
- ↑ J. Ferguson-Lees, D. A. Christie: Die Greifvögel der Welt (deutsch von Volker Dierschke und Jochen Dierschke). Franckh-Kosmos-Verlags-GmbH & Co. KG. Stuttgart, 2009. ISBN 978-3-440-11509-1, S. 248
- ↑ Ülo Väli: Mitochondrial DNA sequences support species status for the Indian Spotted Eagle Aquila hastata. Bull. B.O.C. 126, Heft 3, 2006: S. 238–242 Volltext als pdf ( vom 27. September 2007 im Internet Archive)
- ↑ Andreas J. Helbig, Ingrid Seibold, Annett Kocum, Dorit Liebers, Jessica Irwin, Ugis Bergmanis, Bernd U. Meyburg, Wolfgang Scheller, Michael Stubbe and Staffan Bensch: Genetic differentiation and hybridization between greater and lesser spotted eagles (Accipitriformes: Aquila clanga, A. pomarina). Journal of Ornithology, Band 146, Heft 3, 2005: S. 226–234.
- ↑ a b C. G. Vlachos & N. K. Papageorgiou: Breeding biology and feeding of the Lesser Spotted Eagle Aquila pomarina in Dadia Forest, North-Eastern Greece. In: Meyburg, B.-U. & Chancellor, R.D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: S. 337–347.
- ↑ W. Scheller, U. Bergmanis, B.-U. Meyburg, B. Furkert, A. Knack & S. Röper: Raum-Zeit-Verhalten des Schreiadlers (Aquila pomarina). Acta ornithoecologica 4.2–4, 2001: S. 75–236.
- ↑ B.-U. Meyburg, C. Meyburg, J. Matthes & H. Matthes: GPS-Satelliten-Telemetrie beim Schreiadler Aquila pomarina: Aktionsraum und Territorialverhalten im Brutgebiet. In: Vogelwelt. Band 127, 2006, S. 127–144.
- ↑ M. Rodziewicz: The Status, Range and Breeding Success of the Lesser Spotted Eagle (Aquila pomarina) in Poland. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: S. 291–295.
- ↑ T. Mebs und D. Schmidt: Die Greifvögel Europas, Nordafrikas und Vorderasiens. Franckh-Kosmos, Stuttgart 2006, ISBN 3-440-09585-1: S. 189
- ↑ a b W. Scheller & B.-U. Meyburg: Untersuchungen zur Brutbiologie und Nahrungsökologie des Schreiadlers Aquila pomarina mittels ferngesteuerter Videokamera: Zur Technik und einigen Ergebnissen. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: 245–256.
- ↑ V. Ivanovsky: Notes on the breeding biology of Spotted Eagles Aquila clanga and A. pomarina in Byelorussia. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: 297–299.
- ↑ a b L. Haraszthy, J. Bagyura & T. Szitta: Zur Biologie des Schreiadlers Aquila pomarina in Ungarn. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: 305–312.
- ↑ A. Kemp: Concentration of non-breeding Lesser Spotted Eagles Aquila pomarina at abundant food: a breeding colony of Red-billed Quelea Quelea quelea in the Kruger National Park, South Africa. Acta ornithoecologica 4, 2001: S. 325–329.
- ↑ a b E. Drobelis: On the Biology of the Lesser Spotted Eagle Aquila pomarina in Lithuania. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: S. 283–284.
- ↑ U. N. Glutz v. Blotzheim und K. M. Bauer & E. Bezzel: Handbuch der Vögel Mitteleuropas. Bd. 4., 2. Aufl., Aula-Verlag, Wiesbaden 1989: S. 589
- ↑ Geschwistermord bei Tieren. Die Gnade der späten Geburt? Scinexx, aufgerufen am 9. Januar 2022
- ↑ S. Danko, B.-U. Meyburg, T. Belka & D. Karaska: Individuelle Kennzeichnung von Schreiadlern Aquila pomarina: Methoden, bisherige Erfahrungen und Ergebnisse. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: S. 209–243.
- ↑ B. Acar, M. Beaman & R. F. Porter: Status and Migration of Birds of Prey in Turkey. In: R. D. Chancellor (Hrsg.): World Conference on Birds of Prey. Vienna, 1–3 October, 1975. Report of Proceedings. International Council for Bird Preservation, Hampshire, 1977: S. 182–187.
- ↑ a b E. Dovrat: The Kefar Kassem Raptor Migration Survey, Autumns 1977–1987: a brief summary. In: D. Yekutiel (Hrsg.): Raptors in Israel: Passage and wintering populations. Eilat, 1991: S. 13–30
- ↑ A. Tsovel & D. Allon: Soaring bird migration survey in the Northern Valleys of Israel, Autumns 1988–1990. In: D. Yekutiel (Hrsg.): Raptors in Israel: Passage and wintering populations. Eilat, 1991: S. 31–45
- ↑ a b B.-U. Meyburg, W. Scheller & C. Meyburg: Zug und Überwinterung des Schreiadlers Aquila pomarina: Satellitentelemetrische Untersuchungen. Journal für Ornithologie 136, 1995: S. 401–422
- ↑ NABU: Besenderte Schreiadler auf ihrer Reise. In: www.nabu.de. Abgerufen am 19. März 2015.
- ↑ a b B.-U. Meyburg, C. Meyburg., T. Bělka, O. Šreibr & J. Vrana: Migration, wintering and breeding of a Lesser Spotted Eagle (Aquila pomarina) from Slovakia tracked by satellite. Journal of Ornithology 145, 2004: S. 1–7.
- ↑ H. Shirihai: Eilat – an intercontinental Highway for Migrating Raptors. In: International Birdwatching Center Eilat: Eilat: an Intercontinental Highway for Migrating Birds. Eilat, 1987: S. 23–80.
- ↑ B.-U. Meyburg: Der Schreiadler Aquila pomarina: Bestandssituation und derzeitiger Stand seiner Erforschung. In: Meyburg, B.-U. & Chancellor, R. D. (eds): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: S. 377–387.
- ↑ T. Mebs & D. Schmidt: Die Greifvögel Europas, Nordafrikas und Vorderasiens. Franckh-Kosmos, Stuttgart 2006, ISBN 3-440-09585-1: S. 188.
- ↑ Marina Hochholzner: Nürnberg: Empörung nach Vogelmord an Adler "Dieter". In: nordbayern.de. 4. Dezember 2018, abgerufen am 2. März 2024.
- ↑ C. Sudfeldt, R. Dröschmeister, W. Frederking, K. Gedeon, B. Gerlach, C. Grüneberg, J. Karthäuser, T. Langgemach, B. Schuster, S. Trautmann, J. Wahl: Vögel in Deutschland – 2013, DDA, LAG VSW, Münster 2013, S. 51.
- ↑ Richtlinie 79/409/EWG des Rates vom 2. April 1979 über die Erhaltung der wildlebenden Vogelarten, abgerufen am 5. August 2020
- ↑ Richtlinie 2009/147/EG des Europäischen Parlaments und des Rates vom 30. November 2009 über die Erhaltung der wildlebenden Vogelarten, abgerufen am 5. August 2020
- ↑ Andreas Kinser: Ausstellungseröffnung zum Schreiadler im Ostpreußischen Landesmuseum. Deutsche Wildtier Stiftung, 30. August 2016, abgerufen am 24. November 2020.
Literatur
[Bearbeiten | Quelltext bearbeiten]- James Ferguson-Lees, D. A. Christie: Raptors of the World. Christopher Helm, London 2001, ISBN 0-7136-8026-1.
- D. Forsman: The Raptors of Europe and the Middle East – A Handbook of Field Identification. T & A D Poyser, London 1999, ISBN 0-85661-098-4
- Urs N. Glutz von Blotzheim, Kurt M. Bauer und Einhard Bezzel: Handbuch der Vögel Mitteleuropas. Band 4., 2. Aufl., AULA-Verlag, Wiesbaden 1989, ISBN 3-89104-460-7.
- B.-U. Meyburg: Der Schreiadler Aquila pomarina: Bestandssituation und derzeitiger Stand seiner Erforschung. In: Meyburg, B.-U. & Chancellor, R. D. (eds.): Eagle Studies. WWGBP, Berlin, London, Paris 1996, ISBN 3-9801961-1-9: S. 377–387.
- Thomas Krumenacker: Könige der Lüfte. Frederking & Thaler 2022, ISBN 978-3-95416-348-9
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Clanga pomarina in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: BirdLife International, 2008. Abgerufen am 13. Oktober 2008.
- Schreiadler (Clanga pomarina) auf eBird.org
- Factsheet auf BirdLife International
- Deutsche Wildtier Stiftung ( vom 4. Mai 2010 im Internet Archive) – Schutzprojekt für den Schreiadler
- Europäische Kommission – Artenschutzprogramm Schreiadler
- NABU Mecklenburg-Vorpommern – Schutzprojekt für den Schreiadler