Ammoniumfluorosulfonat
Zur Navigation springen
Zur Suche springen
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| _ N3− _ H+ _ S6+ _ O2− _ F− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||
| Gitterparameter |
| |||||||||
| Allgemeines | ||||||||||
| Name | Ammoniumfluorosulfonat | |||||||||
| Andere Namen |
Ammoniumfluorosulfat | |||||||||
| Verhältnisformel | NH4SO3F | |||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 117,10 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt |
245 °C[2] | |||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Ammoniumfluorosulfonat, NH4SO3F ist eine chemische Verbindung zwischen dem Ammonium und dem Fluorosulfonat-Anion.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Ammoniumfluorosulfonat wird durch die Reaktion von Ammoniumfluorid und Schwefeltrioxid hergestellt.[4]
Eigenschaften
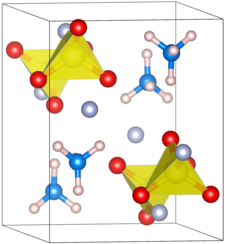
[Bearbeiten | Quelltext bearbeiten]Das Ammoniumsalz der Fluorsulfonsäure bildet ein orthorhombisches Kristallsystem. Es besitzt die Raumgruppe Pnma (Raumgruppen-Nr. 62). Die Gitterparameter liegen bei a = 8,972 Å, b = 5,996 Å, c = 7,542 Å und Z = 4. Der Abstand des Schwefels und des Sauerstoffs beträgt 1,45 Å. Die Länge der Schwefel–Fluor-Bindung ist 1,55 Å lang. Der Winkel der Bindungen O–S–O und F–S–O liegen jeweils bei 113° und 106°.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dale L. Perry: Handbook of Inorganic Compounds. Hrsg.: Sidney L. Phillips. CRC Press, 1995, ISBN 0-8493-8671-3, S. 23.
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2016, ISBN 1-4987-5429-5, S. 4–46.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ K. Jones: The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 1-4831-8756-X, S. 249.
- ↑ K. O’Sullivan, R. C. Thompson, James Trotter: Crystal structure of ammonium fluorosulphate. J. Chem. Soc., 1970, S. 1814–1817, doi:10.1039/J19700001814.
