Benutzerin:ZdBdLaLaLa/Mechanismus
Reaktionsmechanismus[Bearbeiten | Quelltext bearbeiten]

Der Reaktionsmechanismus der Wacker-Oxidation wurde über Jahrzehnte intensiv untersucht, nicht nur wegen der industriellen Bedeutung der Reaktion, sondern auch weil sie den Beginn der katalytischen Palladiumchemie markierte.[1] Die dabei abgewandten Techniken umfassen kinetische Studien, Studien von Isotopeneffekten, stereochemische und theoretische Studien.
Allgemein anerkannte Schritte[Bearbeiten | Quelltext bearbeiten]
Der ablaufende katalytische Kreisprozess (siehe Abbildung) kann in folgenden Bilanzgleichungen zusammengefasst werden:
mit der Gesamtbilanz:
Die Teilreaktionen a) bis c) lassen sich als gekoppelte Teilreaktionen darstellen:[2]
Kinetische Studien[Bearbeiten | Quelltext bearbeiten]
Der genaue Mechanismus der Reaktion blieb lange Gegenstand kinetischer und mechanistischer Studien. Frühe kinetische Studien lieferten eine Geschwindigkeitsgleichung, die erster Ordnung bezüglich des Tetrachloropalladats und des Ethylens war sowie eine Inhibierung erster Ordnung bezüglich des Protons und zweiter Ordnung bezüglich des Chloridions zeigte.[1]
Während sich die inhibierende Wirkung des Chlorids durch die schnellen Gleichgewichtsreaktionen
erklären ließ, gab es für die inhibierende Wirkung des Protons mehrere Erklärungsansätze.[1]
Isotopeneffekte[Bearbeiten | Quelltext bearbeiten]
Die Oxidation von nicht-deuteriertem Ethylen C2H4 in Schwerem Wasser D2O führte nur zur Bildung von nicht deuteriertem Acetaldehyd CH3CHO.[3] Umgekehrt führte die Oxidation von deuteriertem Ethylen C2D4 in normalem Wasser H2O nur zur Bildung von deuteriertem Acetaldehyd CD3CDO. Durch diese Versuche konnte die These, dass der Prozess über eine Vinylalkohol-Zwischenstufe verläuft, bei der ein Wasserstoffatom des Acetaldehyds, etwa über eine Keto-Enol-Tautomerie, aus dem Wasser stammen sollte, widerlegt werden.
Stereochemische Studien[Bearbeiten | Quelltext bearbeiten]
Theoretische Studien[Bearbeiten | Quelltext bearbeiten]
Im ersten Schritt des Reaktionsmechanismus entsteht aus Palladium(II)-chlorid, Ethen und einem Chloridion ein zum Zeise-Salz äquivalenter anionischer Palladium(II)-Ethen-Komplex, das Trichloridoethylenpalladinat(II)-Anion (oben rechts in der Abbildung). Aus Untersuchungen von Substitutionsreaktionen des Zeise-Salzes war bekannt, dass der Ethenligand einen starken trans-Effekt ausübt. Dadurch wird die Bindung des trans-ständigen Chloridoliganden geschwächt[4] und die Anlagerung von Wasser (eines Aquoliganden) unter Verdrängungen eines Chlorid-Liganden erleichtert. Durch diesen Austausch entsteht ein neutraler Palladium(II)-Ethen-Komplex (Abbildung Mitte rechts).[2] Durch Deprotonierung entsteht wieder ein anionischer Ethen-Hydroxo-Komplex. Durch Addition von Wasser und Insertion des Ethen-Liganden in die Pd-OH-Bindung entsteht ein 2-Hydroxyethyl-Komplex.[2]
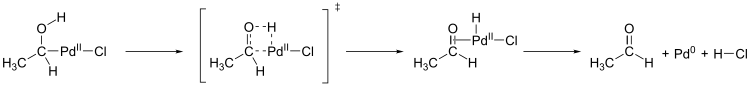
Ein weiterer wichtiger Schritt im Wacker-Prozess ist die Migration des Wasserstoffs von Sauerstoff zu Chlorid und die Bildung der C-O-Doppelbindung (Abbildung unten bis oben links). Der genaue Mechanismus dieses Schritts ist nicht bekannt. Eine Hypothese ist eine β-Hydrid-Eliminierung in einem zyklischen viergliedrigen Übergangszustand:
Berechnungen ergaben jedoch, dass ein viergliedriger Übergangszustand unter β-Hydrid-Eliminierung für diesen Reaktionsschritt energetisch ungünstig ist (151 kJ/mol). Ein durch Wassermoleküle unterstützter fünfgliedriger Übergangszustand mit anschließender reduktiver Elimination ist energetisch günstiger (78,6 kJ/mol) und wird damit als wahrscheinlicher angesehen:[5]
- ↑ a b c Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen Keith. - ↑ a b c Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen steinborn. - ↑ Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen smidt. - ↑ Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen chatt. - ↑ Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen john.
![{\displaystyle \mathrm {(a)\ [PdCl_{4}]^{2-}+C_{2}H_{4}+H_{2}O\rightarrow CH_{3}CHO+Pd+2\ HCl+2\ Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/272108c37754118dfc7ea70418d73f1f4ba6136b)
![{\displaystyle \mathrm {(b)\ Pd+2\ CuCl_{2}+2\ Cl^{-}\rightarrow [PdCl_{4}]^{2-}+2\ CuCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a62f373f2a6e8dc8a4d03e4c022bddbf3a443)



![{\displaystyle v={\frac {k[\mathrm {PdCl_{4}^{2-}} ]\cdot [\mathrm {C_{2}H_{4}} ]}{[\mathrm {H^{+}} ]\cdot [\mathrm {Cl^{-}} ]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d9319e4cb8cae7eafab2012d902a1c72de66b9a)
![{\displaystyle \mathrm {\ [PdCl_{4}]^{2-}+C_{2}H_{4}\rightleftharpoons [PdCl_{3}(C_{2}H_{4})]^{-}+Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a8323b0d4f43fcf81ceaf710c7ddf620212abfa)
![{\displaystyle \mathrm {\ [PdCl_{3}(C_{2}H_{4})]^{-}+H_{2}O\rightleftharpoons [PdCl_{2}(C_{2}H_{4})(H_{2}O)]+Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/01f4bfe55d7c7ee925c1095080ff61ed126c481f)