Chlorazid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
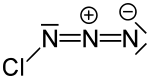
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Chlorazid | ||||||||||||
| Summenformel | ClN3 | ||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 77,47 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−15 °C[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Chlorazid ist eine chemische Verbindung aus der Gruppe der Azide bzw. der Stickstoffhalogenide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Chlorazid kann durch Reaktion von Natriumazid mit Chlor gewonnen werden.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chlorazid ist ein farbloses, leicht zersetzliches, nach Hypochloriger Säure riechendes, bei Druckschwankungen und bei Abkühlung (Ausfrierung) explosives Gas. Es löst sich gelborange in Tetrachlorkohlenstoff. Mit Kohlenwasserstoffen und anderen Lösungsmitteln reagiert Chlorazid langsam. In seinen Reaktionen verhält es sich wie eine Verbindung mit elektropositivem Chlor.[1][4] Es wurde 1908 von Friedrich Raschig erstmals synthetisiert.[5] Die CIN/NN/NN-Abstände betragen 1,745/1,252/1,13 A, der ClNN-Winkel 109°.[4]
Chlorazid zerfällt bei niedrigem Druck unter rotem Leuchten in Stickstoff und Chlor, wenn man das Gas aus einer Kapillare in ein erhitztes Rohr strömen lässt. Das Spektrum dieses Leuchtens zeigt ein Bandensystem von vier Bandengruppen.[6]
Chlorazid reagiert mit Ammoniak.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chlorazid wird bei organischen Synthesen[7] und als Initiator in chemischen Gaslasern verwendet.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 458.
- ↑ a b c Gurdeep Raj: Advanced Inorganic Chemistry Vol-1. ISBN 81-87224-03-7, S. 745 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 685.
- ↑ W. Joe Frierson, A. W. Browne: . In: Journal of the American Chemical Society. 65, 1943, S. 1698–1700, doi:10.1021/ja01249a013.
- ↑ K. Gleu: Die Lichtemission beim Zerfall von Chlorazid. In: Zeitschrift für Physik. Band 38, Nr. 3, März 1926, S. 176–201, doi:10.1007/BF01399108.
- ↑ Stefan Bräse, Klaus Banert: Organic Azides: Syntheses and Applications. John Wiley & Sons, 2010, ISBN 978-0-470-51998-1, S. 244 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard J. Lewis, Sr.: Hazardous Chemicals Desk Reference. John Wiley & Sons, 2008, ISBN 0-470-33445-2, S. 315 (eingeschränkte Vorschau in der Google-Buchsuche).



