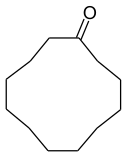
Cyclododecanon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclododecanon | |||||||||||||||
| Summenformel | C12H22O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 182,31 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
0,97 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt |
59 °C[1] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (45 mg·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4571 (60 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclododecanon ist eine chemische Verbindung aus der Gruppe der alicyclischen Ketone (Cycloalkanone). Es kann vom Kohlenwasserstoff Cyclododecan abgeleitet und auch aus diesem erhalten werden.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Cyclododecanon wurde neben anderen Ringketonen erstmals im Chemischen Institut der ETH Zürich in der Arbeitsgruppe von Leopold Ruzicka synthetisiert. Bei seinen Untersuchungen über tierische Riechstoffe (Muscon, Zibeton) erweiterte Ruzicka die Methode der Pyrolyse (Thermolyse) von Dicarbonsäuresalzen,[6] indem er an Stelle von Calcium- oder Bariumsalzen Cer-, Thorium- und Yttriumsalze einsetzte.
So wurde aus Undecandicarbonsäure (= Tridecandisäure) das Thoriumsalz hergestellt; dieses wurde im Vakuum auf 350–400 °C erhitzt. Bei dieser Thermolyse bildete sich – neben anderen Verbindungen – das flüchtige (destillierbare) 12-Ring-Keton in geringer Ausbeute. Die in den Reaktionsprodukten enthaltene Substanz wurde durch Herstellung des Semicarbazons gereinigt. Letzteres wurde durch Hydrolyse mit Salzsäure oder wässriger Oxalsäure in das Keton übergeführt.[1]
Nachdem 1,5,9-Cyclododecatrien industriell zugänglich geworden war, konnte daraus auch Cyclododecanon in großem Maßstab hergestellt werden. Bei einer von BASF eingesetzten Synthese wird aus dem Trien durch Reaktion mit Distickstoffmonoxid Cyclododecadienon erhalten, welches durch Hydrierung zu Cyclododecanon umgesetzt wird.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Die in der Infobox gezeigte Skelettformel gibt nicht die „reale“ Molekülstruktur wieder. Wie beim Kohlenwasserstoff Cyclododecan liegen die zwölf Kohlenstoffatome nicht in einer Ebene. Das Molekül ist „flexibel“, d. h., seine Atome sind intern in ständiger Bewegung (Pseudorotation). Dadurch sind verschiedene Konformationen möglich. Sie ähneln stark den beim Kohlenwasserstoff gefundenen.
Im kristallinen Zustand liegt – wie eine Röntgenkristallstrukturanalyse bei minus 160 °C zeigte – ein Konformer vor, welches C2-Symmetrie aufweist. Es wurde als „quadratisch“ („square“) bezeichnet, denn die Kohlenstoffatome C-2, C-5, C-8 und C-11 lassen sich als Eckpunkte eines Quadrats auffassen.[8] Diese im Kristall bevorzugte Konformation konnte mittels NMR-Spektroskopie bei tiefen Temperaturen auch in Lösung nachgewiesen werden.[9]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cyclododecanon ist ein brennbarer farbloser Feststoff, der nach Campher riecht und praktisch unlöslich in Wasser ist.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Cyclododecanon wird zur Herstellung von Dodecandisäure und Laurinlactam verwendet und wird in der Parfümindustrie eingesetzt.[2] Es wird auch zur Herstellung anderer makrozyklischer Verbindungen wie Muscon verwendet.[10]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Auf Mineralfasern oder auf Kieselgursteine aufgebracht, neigt Cyclododecanon zur Selbstentzündung weit unter dem Zündpunkt von 230 °C.[2]
Trivia
[Bearbeiten | Quelltext bearbeiten]Am 12. September 2012 gab es in einer Kläranlage der BASF SE in Ludwigshafen einen Chemieunfall, bei dem etwa 500 Kilogramm der für Wasserorganismen langfristig giftigen Verbindung in den Rhein flossen. Aufgrund der ausgetretenen Menge und der Verdünnung des Produktes im Rhein ist nach Angaben von BASF nicht von einer Gefährdung von Wasserorganismen auszugehen.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d L. Ruzicka, M. Stoll, H. Schinz: Zur Kenntnis des Kohlenstoffringes II. Synthese der carbocyclischen Ketone vom Zehner- bis zum Achtzehnerring. In: Helvetica Chimica Acta. Band 9, Nr. 1, 1926, S. 249–264, hier: S. 256, doi:10.1002/hlca.19260090130.
- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 830-13-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. November 2012. (JavaScript erforderlich)
- ↑ Datenblatt Cyclododecanon bei Merck, abgerufen am 3. November 2012.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-126.
- ↑ Datenblatt Cyclododecanone, ≥99% bei Sigma-Aldrich, abgerufen am 3. November 2012 (PDF).
- ↑ Siegfried Hauptmann: Organische Chemie. Verlag Harri Deutsch, Thun/Frankfurt am Main 1985, ISBN 3-87144-902-4, S. 219.
- ↑ Fabrizio Cavani, Gabriele Centi, Siglinda Perathoner, Ferruccio Trifirò: Sustainable Industrial Chemistry. John Wiley & Sons, 2009, ISBN 3-527-62912-2, S. 384 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P. Groth: On the Crystal Structure of Cyclododecanone. In: Acta Chemica Scandinavica. 33a, 1979, S. 203–205, doi:10.3891/acta.chem.scand.33a-0203 (freier Volltext).
- ↑ Tarik N. Rawdah: NMR spectroscopic study of the conformational features of cyclododecanone. In: Tetrahedron. Band 47, Nr. 40, 1991, S. 8579–8586, doi:10.1016/S0040-4020(01)82401-7.
- ↑ Tse-Lok Ho: Symmetry: A Basis for Synthesis Design – Tse-Lok Ho. John Wiley & Sons, 1995, ISBN 978-0-471-57376-0, S. 442 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ BASF: Austritt von Cyclododecanon in den Rhein. ( vom 17. Januar 2013 im Webarchiv archive.today) BASF.
