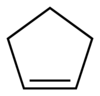
Cyclopenten
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyclopenten | ||||||||||||||||||
| Summenformel | C5H8 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit schwach süßlichem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 68,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,77 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
46 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (535 mg·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Dipolmoment |
0,93 D (in Tetrachlorkohlenstoff)[2] | ||||||||||||||||||
| Brechungsindex |
1,4194[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Cyclopenten ist eine organische Verbindung mit der Summenformel C5H8. Sie besteht aus einem fünfgliedrigen, ungesättigten Ring, welcher eine Doppelbindung aufweist. In der homologen Reihe der Cycloalkene steht Cyclopenten zwischen Cyclobuten und Cyclohexen. Formal handelt es sich um ein einfach hydriertes Cyclopentadien beziehungsweise ein einfach dehydriertes Cyclopentan. Cyclopenten besitzt nur wenige Anwendungen.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Cyclopenten ist durch Steamcracken von Naphtha erhältlich, wobei etwa 2,2 kg Cyclopenten je Tonne Naphtha anfallen. Effizienter wird es hingegen durch katalytische Hydrierung von Cyclopentadien hergestellt.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cyclopenten geht für cyclische Alkene übliche Reaktionen wie Additionen an die Doppelbindung und Cycloadditionen ein. Substitutionsreaktionen finden meist in allylischer Position statt.[2] Durch die katalytische Oxidation von Cyclopenten mit Sauerstoff lässt sich Cyclopentanon synthetisieren.[4] Die stereoselektive Bildung von trans-Tricyclo[5.3.0.02,6]decan durch photochemische Dimerisierung von Cyclopenten ist ein einfaches Beispiel für eine Photodimerisierung durch [2+2]-Cycloaddition:[5]

Die Reaktion verläuft mit 55%iger Ausbeute.[5]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Cyclopenten in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ a b c d D. Hönicke, R. Födisch, P. Claus, M. Olson: Cyclopentadiene and Cyclopentene, in: Ullmanns Enzyklopädie der Technischen Chemie 2002, Wiley-VCH, Weinheim.
- ↑ Datenblatt Cyclopenten bei Alfa Aesar, abgerufen am 2. März 2010 (Seite nicht mehr abrufbar).
- ↑ J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Rüttinger, H. Kojer: Katalytische Umsetzungen von Olefinen an Platinmetall-Verbindungen Das Consortium-Verfahren zur Herstellung von Acetaldehyd, in: Angew. Chem. 1959, 71, 176–182; doi:10.1002/ange.19590710503.
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 143, ISBN 978-3-906390-29-1.


