Wolbachia pipientis
| Wolbachia pipientis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
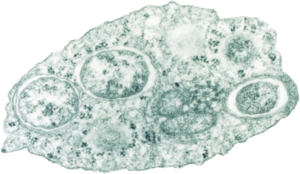
Wolbachia pipientis innerhalb einer Insektenzelle | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Wolbachia | ||||||||||||
| Hertig, 1936 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Wolbachia pipientis | ||||||||||||
| Hertig, 1936 |
Wolbachia pipientis ist ein gramnegatives Bakterium und die einzige Art der Gattung Wolbachia innerhalb der Familie Ehrlichiaceae. Die pleomorphen Bakterien können als Bazillen von 0,5 bis 1,3 µm Länge, als Kokken von 0,25 bis 1,0 µm Durchmesser und als Riesenformen von 1 bis 1,8 µm Durchmesser auftreten. Das Bakterium hat sich in vitro und in vivo als empfindlich gegenüber Doxycyclin und Rifampicin erwiesen. Die Bakterien wachsen obligat in den Vakuolen der Zellen ihrer Wirte oder Symbionten und können nicht außerhalb dieser Umgebung kultiviert werden. Es gibt aber seit 1997 Zelllinien aus Eiern der Asiatischen Tigermücke (Aedes albopictus), mit und ohne Infektion mit Wolbachia pipientis.
Wolbachia pipientis ist erstmals in den Keimdrüsen der Gemeinen Stechmücke nachgewiesen worden. Bislang wurde das Bakterium in Insekten und anderen Gliederfüßern wie Krebstiere und Spinnentiere und in Filarien identifiziert. Dabei ist die Beziehung zwischen Wolbachia und ihren Wirten oder Symbionten vielgestaltig. Sie reicht von einer bei Arten von Drosophila beobachteten pathogenen Wirkung über Parasitismus und Mutualismus bis zur obligatorischen Symbiose. Wolbachia beeinflusst auf vielfältige Weise die Fortpflanzung der Wirte, wodurch insgesamt die weiblichen Tiere begünstigt und männlicher Nachwuchs im Embryonalstadium abgetötet oder phänotypisch feminisiert und so von der weiteren Reproduktion ausgeschlossen wird. Bei Insekten wird der Anteil infizierter Arten auf etwa 16 Prozent geschätzt.
Viele der betroffenen Wirte oder Symbionten sind Vektoren von Infektionskrankheiten. Zu ihnen gehören die Gelbfiebermücke, der Anopheles gambiae-Komplex und verschiedene Zecken. Unter den Filarien befinden sich bedeutende humanpathogene Parasiten wie Onchocerca volvulus, Wuchereria bancrofti und Brugia malayi. Wolbachia konnte nachgewiesen werden, dass sie die Erregerlast bei einigen Vektoren reguliert. Die Möglichkeit, die Reproduktion von Insektenvektoren durch das Aussetzen infizierter Männchen zu stören oder pathogene Filarien im Körper der erkrankten Tiere oder Menschen durch das Abtöten ihrer obligaten Symbionten Wolbachia zu bekämpfen, ist Gegenstand jüngerer Forschungen.
Merkmale
[Bearbeiten | Quelltext bearbeiten]Wolbachia pipientis ist ein gramnegatives und pleomorphes Bakterium. Die beschriebenen Formen sind Bazillen von 0,5 bis 1,3 µm Länge, Kokken von 0,25 bis 1,0 µm Durchmesser und Riesenformen von 1 bis 1,8 µm Durchmesser. Die Gattung Wolbachia unterscheidet sich von den Gattungen Anaplasma, Ehrlichia und Neorickettsia dadurch, dass sie keine Morulae bilden und nur Gliederfüßer und Filarien besiedeln. Sie unterscheidet sich von den Schwestertaxa auch durch ihre 16S rRNA, auf die sich heute die Systematik der Bakterien stützt.[1]
Von mehreren Stämmen von Wolbachia pipientis wurde bereits das Genom sequenziert. Der Stamm wMel (Supergruppe A, von Drosophila melanogaster) weist 1.267.782 Basenpaare und 1271 Protein-codierende Gene auf, während der Stamm wBm (Supergruppe D, von Brugia malayi) nur 1.080.084 Basenpaare und 806 Protein-codierende Gene hat. Ein gegenüber frei lebenden verwandten Arten verkleinertes Genom weisen auch Bakterien auf, die obligate Symbionten von Insekten sind. Beispiele sind Buchnera aphidicola, ein Symbiont der Erbsenlaus, Blochmannia sp. bei Rossameisen und Wigglesworthia glossinidia bei Tsetsefliegen. Das kleinere Genom der obligaten Symbionten bei Wolbachien wird als evolutionäre Anpassung verstanden. Demnach sind die bei parasitierenden Supergruppen noch vorhandenen Gene für Mechanismen des Eindringens in die Wirte und deren Manipulation als nutzlos verloren gegangen.[2][3][4]
Lebensweise
[Bearbeiten | Quelltext bearbeiten]Wolbachia lebt obligat in den Vakuolen der Zellen ihrer Wirte oder Symbionten, in denen sie sich durch Schizotomie vermehrt. In Gliederfüßern befinden sich die Wolbachien vorwiegend im Zytoplasma von Zellen der Geschlechtsorgane, aber auch von Nervenzellen und Blutkörperchen. Bei Filarien werden die Zellen der lateralen Nervenstränge und der weiblichen Fortpflanzungsorgane besiedelt. In allen Wirten erfolgt die vertikale Transmission von einer Generation zur nächsten, wobei männliche Wirte nur mittelbar oder gar nicht beteiligt sind.[1] Die große Verbreitung unter den Gliederfüßern und anderen Wirbellosen resultiert aus einer über lange Zeiträume immer wieder stattfindenden horizontalen Transmission zwischen den Wirten.[5]
Wirkung auf die Wirte
[Bearbeiten | Quelltext bearbeiten]Die Wirkungen von Wolbachia auf ihre Wirte werden jeweils als Strategien verstanden, die dem Bakterium eine hohe Übertragungsrate und eine weite Verbreitung sichert.[1]
Feminisierung
[Bearbeiten | Quelltext bearbeiten]Bei der Rollassel Armadillidium vulgare wird der Hormonhaushalt der Nachkommen gestört, so dass sich auch aus genotypisch männlichen Individuen phänotypische Weibchen entwickeln. Da zytoplasmische Merkmale, Mitochondrien und auch Wolbachien infizierter Tiere nur von Weibchen in die folgende Generation weitergegeben werden, ist mit der Feminisierung ein Vorteil für Wolbachia verbunden. Der Mechanismus besteht in der Unterdrückung der Entwicklung jener Drüsen, die männliche Sexualhormone produzieren. Die feminisierten genetischen Männchen stehen den nicht infizierten Männchen als Sexualpartner zur Verfügung, obwohl diese, wenn sie die Wahl haben, genetische Weibchen bevorzugen. Zudem ist die Feminisierung häufig unvollständig, die betroffenen Individuen weisen eine Mischung von männlichen und weiblichen Merkmalen auf. In feminisierten Populationen entsteht ein Mangel an männlichen Tieren, der teilweise durch größere sexuelle Aktivität der verbliebenen nicht infizierten Männchen kompensiert wird.[1][5]
Das einzige bislang bekannte Insekt, das eine feminisierende Wirkung von Wolbachien zeigt, ist der Tagfalter Eurema hecabe. Die Entfernung von Wolbachia durch die Gabe eines Antibiotikums führt dazu, dass die betroffenen Tiere nur noch männliche Nachkommen zeugen. Bei dem wirtschaftlich bedeutenden Pflanzenschädling Ostrinia scapulalis, einem Kleinschmetterling aus der Familie der Crambidae, wurde ebenfalls eine Feminisierung vermutet, tatsächlich wird die ausschließlich weibliche Nachkommenschaft infizierter Weibchen durch das Töten der männlichen Embryonen bewirkt.[5]
Da die vollständige Beseitigung fortpflanzungsfähiger genetischer Männchen in einer Population den Untergang sowohl des Wirtes, als auch seines Parasiten bewirken würde, gibt es eine Reihe von Mechanismen zum Erhalt der Arten. Bei der Mauerassel Oniscus asellus werden weniger als 88 Prozent der Nachkommen mit Wolbachia infiziert. Dadurch ist sichergestellt, dass sich in der folgenden Generation stets fortpflanzungsfähige Männchen befinden. Bei Insektenarten mit männlicher Heterogametie ist die Feminisierung mit einer hohen Sterblichkeit des Nachwuchses verbunden. Daher sind Gruppen wie die Hautflügler nicht von einer Feminisierung der Männchen betroffen.[5]
Parthenogenese
[Bearbeiten | Quelltext bearbeiten]Eine weitere Strategie, weibliche Individuen als Überträger der Wolbachien zu begünstigen, besteht in der Parthenogenese. Weil sämtliche Nachkommen weiblich und Träger der Infektion sind, wird auch der Fortpflanzungserfolg des Bakteriums verdoppelt. Durch Wolbachien induzierte Parthenogenese wurde bislang in drei Ordnungen nachgewiesen, den Fransenflüglern (Thysanoptera) und Hautflüglern (Hymenoptera) bei den Insekten und den Trombidiformes bei den Spinnentieren. Damit konzentriert sich die Parthenogenese bei Wolbachia-infizierten Gliederfüßern auf Arten mit haplodiploider Geschlechtsdetermination.[5]
Unter den Rüsselkäfern wurde eine einzige parthenogenetische Art, Naupactus tesselatus, als Träger von Wolbachien identifiziert. Es ist jedoch noch nicht geklärt, ob das Bakterium bei der Entwicklung der Parthenogenese bei diesem und anderen parthenogenetischen Rüsselkäfern eine Rolle gespielt hat. Die bei einigen Arten der Gattung Drosophila nachgewiesenen Wolbachien scheinen nicht mit der Parthenogenese in Zusammenhang zu stehen. Wolbachien induzieren Parthenogenese auf unterschiedliche Weise. Es sind drei Wege beschrieben worden, zwei automiktische und ein apomiktische. Im Unterschied zu den Strategien der Feminisierung, des Male-Killing und der Zytoplasmischen Inkompabilität kann das Induzieren der Parthenogenese zum Erlöschen des männlichen Geschlechts führen. Es gibt aber auch Fälle, wie bei einigen Arten der Wespengattung Trichogramma, in denen infizierte und nicht infizierte Individuen koexistieren. Die infizierten unbefruchteten Weibchen vermehren sich parthenogenetisch und produzieren nur infizierte weibliche Nachkommen, während die nicht infizierten Weibchen unbefruchtet nicht infizierte weibliche Nachkommen und befruchtet nicht infizierte Männchen hervorbringen. Die Bevorzugung weiblicher Nachkommen kann Männchen selten werden lassen. Bei der Wespe Telenomus nawai (Hymenoptera: Scelionidae) wurde eine Mutation festgestellt, die nicht infizierte Weibchen sowohl unbefruchtet als auch befruchtet in großer Zahl männlichen Nachwuchs produzieren lässt.[5]
Male Killing
[Bearbeiten | Quelltext bearbeiten]Male Killing (MK) bezeichnet das Töten männlicher Nachkommen während der Embryogenese. Diese Strategie kann nur dann für die Wolbachien von Vorteil sein, wenn sie die infizierten Schwestern der absterbenden Männchen begünstigt. Das ist regelmäßig dort der Fall, wo Geschwister miteinander im Wettbewerb um knappe Ressourcen stehen. Man hat beobachtet, dass mit Wolbachia infizierte Weibchen des tropischen Schmetterlings Hypolimnas bolina ausschließlich weibliche Nachkommen hervorbringen. Zu den Insekten, bei denen die Infektion mit Wolbachien zum Tod der männlichen Nachkommen führt, gehört auch der Kleinschmetterling Ostrinia scapulalis. Während männliche Individuen als Larve absterben, sind weibliche Tiere zwingend auf Wolbachien angewiesen. Wenn das Bakterium mit Tetracyclin abgetötet wird, sterben auch die Weibchen. Im Experiment konnten infizierte Männchen durch die Mikroinjektion einer geringen Zahl von Wolbachien erzeugt werden. Auch die Tetracyclin-Behandlung von Weibchen kurz vor der Eiablage führte zur Entwicklung lebensfähiger infizierter männlicher Nachkommen, wenn sie in einem nicht tödlichen Ausmaß infiziert waren. Die Körper dieser Männchen wiesen eine Mischung männlicher und weiblicher Gewebe auf. Eine höhere Bakterienlast führte auch bei diesen Experimenten zum Absterben männlicher Larven.[5][6][7]
Weitere Insekten, in denen die Strategie des Male Killing verfolgt wird, sind die Taufliegen Drosophila bifasciata und Drosophila innublia, die Käfer Tribolium madens und Adalia bipunctata und der Schmetterling Acraea encedon. Auch der Pseudoskorpion Cordylochernes scorpioides gehört zu den betroffenen Arten.[5]
Zytoplasmische Inkompatibilität
[Bearbeiten | Quelltext bearbeiten]Die Zytoplasmische Inkompatibilität (CI) ist die am weitesten verbreitete Wirkung einer Infektion mit Wolbachien. Die Paarung eines infizierten Männchens mit einem Weibchen, das nicht oder mit einem anderen Stamm infiziert ist, führt zur gesteigerten Mortalität der Nachkommen. Im Extremfall sterben alle Nachkommen in der Embryonalphase ab. Durch diese Fehlpaarung werden die betroffenen Weibchen effektiv von der Fortpflanzung ausgeschlossen, nur die Überträgerinnen eines kompatiblen Bakterienstamms bringen mit infizierten Männchen lebensfähige infizierte Nachkommen hervor. Bezogen auf die Gesamtpopulation werden infizierte gegenüber nicht infizierten Weibchen im Fortpflanzungserfolg begünstigt.[1][8]
Der bezeichnete Effekt wurde nicht nur theoretisch vorhergesagt, sondern konnte in den 1980er Jahren bei der Ausbreitung von Wolbachien in einer ursprünglich nicht infizierten kalifornischen Population von Drosophila simulans beobachtet werden. Der genaue Wirkmechanismus ist noch unbekannt, die Spermien infizierter Männchen enthalten keine Wolbachien. Während der Spermatogenese müssen also die Spermien so manipuliert worden sein, dass sie bei der Befruchtung der Eier, abhängig vom Infektionsstatus des Weibchens, lebensfähige oder nicht lebensfähige Nachkommen zeugen.[5]
Die Zytoplasmische Inkompatibilität kann eine Reihe von phänotypischen Veränderungen bewirken, die auch bei Mutationen der Gene maternal haploid, ms(3)K81 und sésame der häufig in der Genetik als Modellorganismus genutzten Taufliege Drosophila melanogaster vorkommen. Auch bei der Untersuchung von Mutationen, die die Reproduktion beeinflussen, kann eine Infektion mit Wolbachien in entwicklungsbiologischen Laboren Untersuchungsergebnisse verfälschen. Ein großer Teil der in der Forschung genutzten Drosophila-Stämme ist mit Wolbachien infiziert.[5]
Beeinflussung der Oogenese
[Bearbeiten | Quelltext bearbeiten]Die parasitoide Wespe Asobara tabida ist bei der Oogenese auf die Anwesenheit von Wolbachia pipientis angewiesen. Der Mechanismus ist noch nicht detailliert untersucht, aber die Behandlung mit Antibiotika zur Beseitigung der Wolbachien führt dazu, dass die Weibchen keine fruchtbaren Eier mehr produzieren. Damit wird der Ausschluss nicht infizierter Weibchen von der Fortpflanzung bewirkt. Asobara tabida ist stets mit Wolbachien dreier Stämme infiziert, wobei nur einer die Oogenese beeinflusst und die beiden anderen zytoplasmische Inkompatibilität bewirkt.[9]
In vitro-Kultivierung
[Bearbeiten | Quelltext bearbeiten]Wolbachia pipientis ist auf lebende Wirtszellen angewiesen und kann nicht alleine in einem Nährmedium am Leben erhalten werden. Es ist aber bereits 1997 gelungen, eine natürlich mit Wolbachia pipientis infizierte Zelllinie aus Eiern der Asiatischen Tigermücke (Aedes albopictus) zu kultivieren. Das Nährmedium war eine Mischung aus gleichen Teilen Mitsuhashi-Maramorosch-Insektenmedium und Schneiders Insektenmedium, dem 10 bis 15 Prozent Fetales Kälberserum zugefügt wurden. Dieser Wolbachia-Stamm wird auch nach dem Entwickler der Methode O’Neill-Stamm genannt und kann auch auf Kulturen von Fibroblasten aus humanem embryonalem Lungengewebe und auf einer anderen Zelllinie von Aedes albopictus in einem speziellen Nährmedium vermehrt werden.[1][10]
Eine Gruppe japanischer Molekulargenetiker entdeckte 2000 in Chromosomen verschiedener Stämme von Wolbachia genetisches Material des Bakteriophagen WO. Wie andere artspezifische Bakteriophagen spielt auch der Bakteriophage WO eine Rolle bei der Synthese eines mikrobiellen Toxins, indem er das genetische Material für die Toxinproduktion kodiert.[8]
Wirte und Symbionten
[Bearbeiten | Quelltext bearbeiten]Wolbachien infizieren eine große Bandbreite von Organismen. Dabei sind die Infektionen von Gliederfüßern meist parasitischer Natur, und die Infektionen von Nematoden eher symbiotischer Art. Wirbeltiere werden nicht infiziert.[5]
Gliederfüßer
[Bearbeiten | Quelltext bearbeiten]Die Schätzungen des Anteils der Insektenarten, die von Wolbachia pipientis infiziert werden, reichen von 16 bis 76 Prozent. Hinzu kommen zahlreiche weitere Arten von Gliederfüßern und Nematoden.[11] Die Verteilung innerhalb der taxonomischen Gruppen ist sehr unterschiedlich. Bei den Tierläusen scheinen Wolbachien fast alle Arten zu infizieren, während die als Vektoren zahlreicher Infektionskrankheiten bedeutenden Mücken der Gattung Anopheles frei von natürlichen Infektionen sind.[5]
Unter den Landasseln sind mehrere Arten mit Wolbachien der Supergruppe B infiziert, die eine Feminisierung männlicher infizierter Tiere bewirken.[5]
Filarien
[Bearbeiten | Quelltext bearbeiten]Einige humanpathogene Filarien wie Onchocerca volvulus, Wuchereria bancrofti, Brugia malayi und Brugia timori sind obligate Träger der endosymbiotisch lebenden Wolbachien. Eine veterinärmedizinisch bedeutende Art ist Dirofilaria immitis als Erreger der Herzwurmerkrankung des Hundes. Die Wolbachien werden mit den Eizellen in die jeweils nächste Generation weitergegeben und sind phylogenetischen Untersuchungen zufolge seit Millionen Jahren symbiotisch mit den Filarien verbunden. Die gemeinsame Evolution beider Arten und molekulargenetische Untersuchungen, die keine Hinweise auf Abwehrmechanismen gegen Wolbachia bei den Wirten und Reaktionen der Wolbachien darauf erkennen ließen, stützen die These der mutualistischen Beziehung.[12][2][13]
Die Verbreitung der Wolbachien bei den Filarien geht wahrscheinlich auf ein Infektionsereignis zurück, das die gemeinsamen Vorfahren der Unterfamilien Onchocercinae und Dirofilariinae betraf. Es ist noch ungeklärt, wie groß der Anteil von obligaten und fakultativen Trägern der Wolbachien unter den Arten der Filarien ist, und warum bei nahe verwandten Arten obligate Träger und Nicht-Träger vorkommen. Offenbar bietet Wolbachia den Trägern einen evolutionären Vorteil, der noch nicht identifiziert werden konnte. Bei einzelnen Arten ist die symbiotische Bindung an Wolbachia im Laufe der Evolution wieder verlorengegangen zu sein. Zu einem derartigen Verlust muss es in der Phylogenese der Onchocerciden mindestens sechs Mal gekommen sein.[2][14]
Die von diesen Filarien verursachten Erkrankungen des Menschen, die Onchozerkose der Haut und der Augen und die lymphatische Filariose mit der besonders schweren Form der Elephantiasis, gehören zu den schwersten und am weitesten verbreiteten Parasitosen. Die Erreger werden durch Mücken und Fliegen übertragen, die bei einer Blutmahlzeit von einem infizierten Wirt Mikrofilarien aufnehmen und sie bei den folgenden Wirten abgeben können. In den einer Neuinfektion folgenden zehn bis fünfzehn Jahren bei Onchocerca und fünf und mehr Jahren bei lymphatischer Filariose wachsen die Filarien im Wirt heran, vermehren sich millionenfach und können von Blutsaugern wieder aufgenommen und verbreitet werden. Zu Beginn des 21. Jahrhunderts waren weltweit 200 Millionen Menschen mit Filarien infiziert und mehr als eine Million Menschen exponiert.[12][15]
Bei Filarien infiziert Wolbachia die Zellen der lateralen Nervenstränge beider Geschlechter in allen Stadien, von den Mikrofilarien bis zum adulten Tier. Darüber hinaus werden die Geschlechtsorgane und die Eizellen der weiblichen Filarien und die Vorläufer der lateralen Nervenstränge in den Embryonalstadien infiziert, nicht jedoch die Geschlechtsorgane der männlichen Filarien. Vermutlich im Zusammenhang mit der Reproduktion kommt es in den Körpern der weiblichen Filarien kurz nach dem Befall eines Säugetierwirts zur Vervielfachung der Wolbachien. Da im Genom der Filarie Brugia malayi keine Gene identifiziert werden konnten, die bei anderen Tieren für die Produktion der Häme sorgen, wird den Wolbachien die Versorgung der Filarien mit Hämen zugeschrieben.[11][2]
Wolbachien tragen entscheidend zur Entwicklung, Fortpflanzung und pathogenen Wirkung der Filarien bei. Sie bewirken die Akkumulation und Aktivierung von neutrophilen Granulozyten um die Filarien und aktivieren Makrophagen. Die Neutrophilen sind wiederum am Abtöten und Abbauen der Mikrofilarien und am Entstehen der Onchozerkose als Ort der Kopulation geschlechtsreifer Onchocerca volvulus beteiligt. Im Mausmodell der Onchozerkose tragen Wolbachien und die von ihnen verursachte Reaktion der Neutrophilen entscheidend zur Keratitis als gravierendstem Symptom der Erkrankung bei, während die ebenfalls beteiligten eosinophilen Granulozyten durch die Anwesenheit der Mikrofilarien und die Makrophagen durch beide aktiviert werden.[12][16]
Wolbachien in der biologischen Schädlingsbekämpfung
[Bearbeiten | Quelltext bearbeiten]Der Verlust des Endosymbionten Wolbachia durch die Gabe von Antibiotika, Hitzeeinwirkung oder Entzug bestimmter Nährstoffe hat in Versuchen eine Vielzahl von Wirkungen auf den Wirt gezeigt: Unvollständige Ausbildung, abweichende Färbung des Exoskeletts, Kleinwüchsigkeit, Sterilität und Tod.[11]
Aedes aegypti und andere Mückenarten verlieren bei Infektion mit Wolbachia pipiens ihre Fortpflanzungsfähigkeit. Dies kann möglicherweise gezielt genutzt werden, indem man Wolbachia-infizierte männliche Mücken in großer Zahl in die Umwelt entlässt und der entstehende Nachwuchs aus gesunden weiblichen Tieren und infizierten männlichen Mücken nicht lebensfähig ist. Eine zweite Reproduktionsperiode erleben die Tiere nicht, so dass die Population dramatisch an Größe verliert. Die betroffenen Mückenarten sind Vektoren für verschiedene humanpathogene Arboviren, wie z. B. das Dengue-Virus[17][18] und den Malaria-Erreger Plasmodium.[19][20][21]
Die konventionelle Therapie der Filariosen besteht in der langfristigen Therapie mit filariziden Wirkstoffen wie Ivermectin, Albendazol und Diethylcarbamazin, meist in Kombination. Dabei werden die adulten Würmer nicht sicher abgetötet, so dass sich die Behandlung oft über mehrere Jahre bis zu ihrem natürlichen Tod erstrecken muss. Darüber hinaus führt die Therapie nach dem Absterben der Mikrofilarien zur Freisetzung von Wolbachien oder Lipopolysaccharid-ähnlichen Molekülen, die unerwünschte Immunreaktionen hervorrufen können.[22][23] Das Abtöten der Wolbachien durch den Einsatz von Antibiotika wie Doxycyclin könnte eine Möglichkeit der effektiven Bekämpfung der Filariosen sein. Der Verlust der Wolbachien führt zur langfristigen oder dauerhaften Sterilität der fortpflanzungsbereiten Filarien, so dass keine Fortpflanzung mehr stattfindet. Im Tierversuch wurde bei der Therapie der Rinder-Onchozerkose auch eine filarizide Wirkung beobachtet. Allerdings ist eine Therapie mit Doxycyclin bei Schwangeren, Stillenden und Kindern unter zehn Jahren kontraindiziert, so dass für diese Patienten weiter auf konventionelle Filarizide zurückgegriffen werden muss.[12][15]
Systematik
[Bearbeiten | Quelltext bearbeiten]Erstbeschreibung
[Bearbeiten | Quelltext bearbeiten]Wolbachia wurde 1924 von den US-amerikanischen Mikrobiologen Marshall Hertig und Simeon Burt Wolbach entdeckt.[24] Die Erstbeschreibung erfolgte 1936 durch Hertig, wobei er die Gattung nach seinem Kollegen Wolbach benannte und das Artepithet an den wissenschaftlichen Namen des Typuswirts Culex pipiens anlehnte.[25][1]
Äußere Systematik
[Bearbeiten | Quelltext bearbeiten]Wolbachia wurde zunächst in die Tribus Wolbachieae der Familie Rickettsiaceae aufgenommen. Im Rahmen einer Revision der Ordnung Rickettsiales durch den US-amerikanischen Parasitologen Cornelius Becker Philip wurde sie 1956 mit den Gattungen Aegyptianella, Anaplasma, Ehrlichia und Neorickettsia in die Familie Anaplasmataceae gestellt. Diese Verwandtschaftsbeziehung wurde durch molekulargenetische Untersuchungen bestätigt.[1][26] Im Jahr 2020 erfolgte eine größere taxonomische Untersuchung der innerhalb der Alphaproteobacteria geführten taxonomischen Einteilung.[27] Hierbei wurde die Familie Anaplasmataceae aufgelöst und die Gattungen zu der wieder aufgestellten Familie Ehrlichiaceae gestellt.[28]
Wolbachia nimmt dabei eine Position zwischen den mit Würmern assoziierten Bakterien der Gattung Neorickettsia und den von Zecken übertragenen Anaplasma und Ehrlichia ein.[5]
In der zweiten Hälfte des 20. Jahrhunderts wurden mehrere Arten der Gattung Wolbachia beschrieben, die mittlerweile in anderen Gattungen stehen oder lediglich Synonyme von Wolbachia pipientis sind:
- Wolbachia persica Suitor & Weiss 1961[29] ist ein Synonym von Francisella persica;[30]
- Wolbachia popcon ist eine in der zweiten Auflage von Bergey’s Manual of Systematic Bacteriology verwendete Falschschreibung von W. popcorn;
- Wolbachia popcorn Min & Benzer 1997[31] bezeichnet nur einen Stamm popcorn, aufgrund des Erscheinungsbilds infizierter Zellen;[31]
- Wolbachia postica Hsiao & Hsiao 1985[32] ist ein Synonym von W. pipientis (Supergruppe B).[33]
Innere Systematik
[Bearbeiten | Quelltext bearbeiten]Obgleich heute nur eine Art der Gattung Wolbachia anerkannt ist, wird innerhalb der Art eine hohe Diversität beobachtet. Diese Diversität wird nicht wie üblich in Form der Beschreibung weiterer Arten, sondern durch die Einteilung in Supergruppen zum Ausdruck gebracht.[2]
Aktuell werden bei Wolbachia pipientis 16 Supergruppen unterschieden, die mit den Buchstaben A bis Q bezeichnet werden und eine Klade bilden. Die Supergruppe G hat sich als eine Rekombination der Supergruppen A und B erwiesen.[34] Einer Beschreibung der von Höhlenspinnen der Gattung Telema isolierten Supergruppe R wurde 2016 widersprochen.[35][36] Ein Versuch, die Art Wolbachia pipientis in zahlreiche Arten aufzuspalten, wobei nur die Supergruppe B als Wolbachia pipientis erhalten bleiben sollte, stieß auf Ablehnung.[37][38][39]
Forschungsgeschichte
[Bearbeiten | Quelltext bearbeiten]Wolbachia pipientis wurde 1924 von den US-amerikanischen Entomologen Marshall Hertig und dem Pathologen Simeon Burt Wolbach entdeckt. Seinerzeit erforschten Hertig und Wolbach die Vektoren, die in den Vereinigten Staaten Rickettsien übertragen und Infektionskrankheiten wie Fleckfieber und Rocky-Mountain-Fleckfieber hervorrufen. Einer ihrer Funde war ein zunächst unbenannter Rickettsien-ähnlicher Mikroorganismus aus den Keimdrüsen der Gemeinen Stechmücke (Culex pipiens). Erst 1936 veröffentlichte Hertig die Erstbeschreibung von Wolbachia pipientis.[24][25][11]
In den folgenden Jahrzehnten war Wolbachia ein weitgehend unbeachteter Mikroorganismus. In den 1960er und 1970er Jahren wurden von mehreren Forschern ungewöhnliche Strukturen in den Eizellen verschiedener Filarien beobachtet, die sie nicht identifizieren konnten. Erst 1995 wurden die Verursacher als Endosymbionten der Gattung Wolbachia erkannt. Mit den gesteigerten Bemühungen der Weltgesundheitsorganisation zur Beseitigung der Filariosen, die auch die Entschlüsselung der Genome humanpathogener Filarien einschlossen, kam es zu Funden bakterieller DNA, die zunächst als Kontamination der Proben gedeutet wurden. Auch sie waren durch Wolbachia pipientis verursacht.[11]
1973 wurden mit Armadillidium vulgare erstmals eine Landassel als Wirt von Wolbachia pipientis identifiziert. Weitere Arten folgten in den Jahren darauf. Die infizierten Asseln zeichnen sich dadurch aus, dass männliche Nachkommen infizierter Asseln feminisiert werden.[5]
1977 begann man zu verstehen, dass Wolbachien ihre Wirte in der Regel nicht parasitieren, sondern mit ihnen eine mutualistische Beziehung eingehen. Das wurde daraus gefolgert, dass insbesondere das Abtöten der Wolbachien in Filarien mit negativen Folgen für die Wirte bis hin zum Tod verbunden ist.[11]
2005 war das Genom von Wolbachia-Stämmen der Filarien entschlüsselt, so dass ein Vergleich mit dem Genom der Stämme von Arthropoden möglich wurde.[41]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Pilotprogramm zeigt Wirkung: Dengue-Fieber wird mit Bakterien bekämpft (Dengue-Virus). Auf: n-tv.de vom 5. März 2024.
- Meng-Yan Chen, Dong Li, Zhi-Ning Wang, Feng-Zhen Xu, Yi-Wei Feng, Qiong-Lin Yu, Ying-Ying Wang, Shu Zhang, Yu-Feng Wang: Infection by virulent wMelPop Wolbachia improves learning and memory capacity in Drosophila melanogaster. In: Animal Behaviour, Band 212, Juni 2024, S. 101–112; doi:10.1016/j.anbehav.2024.03.016 (englisch). Dazu:
- Clare Watson: Bacteria Living in The Brains of Fruit Flies Have a Surprising Effect on Their Memory. Auf: sciencealert vom 7. Mai 2024.
- NCBI Taxonomy Browser: Wolbachia sp. wMelPop (species), Wolbachia pipientis wMelPop (strain).
Offenbar ist nicht klar, ob der Stamm wMelPop eine eigene Spezies darstellt oder zu W. pipientis gehört.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Bernard La Scola, Claudio Bandi, Didier Raoult: Genus IV. Wolbachia Hertig 1936, 472AL. In: George M. Garrity, Don J. Brenner, Noel R. Krieg, James T. Staley (Hrsg.): Bergey’s Manual of Systematic Bacteriology. Second Edition. Volume Two. The Proteobacteria. Part C. The Alpha-, Beta-, Delta-, and Epsilonproteobacteria. Springer, New York 2005, ISBN 0-387-24145-0, S. 138–143.
- ↑ a b c d e f Maurizio Casiraghi, Emanuele Ferri, Claudio Bandi: Wolbachia: Evolutionary Significance in Nematodes. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 15–30.
- ↑ Kenneth Pfarr, Jeremy Foster, Barton Slatko: It Takes Two: Lessons From the First Nematode Wolbachia Genome Sequence. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 52–65.
- ↑ R. Yamada, J. C. Brownlie, E. A. McGraw, S. L. O’Neill: Insights into Wolbachia Biology Provided through Genomic Analysis. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 77–89.
- ↑ a b c d e f g h i j k l m n o Michael E. Clark: Wolbachia Symbiosis in Arthropods. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 90–123.
- ↑ Frédéric Landmann: The Wolbachia Endosymbionts. In: Microbiology Spectrum. Band 7, Nr. 2, 2019, BAI-0018-2019, doi:10.1128/microbiolspec.BAI-0018-2019.
- ↑ Männer-Killer im Gewächshaus: Dieses Virus tötet ausschließlich Männchen. Auf: n-tv.de vom 13. November 2023.
- ↑ a b Shinji Masui, Satoru Kamoda, Tetsuhiko Sasaki, Hajime Ishikawa: Distribution and Evolution of Bacteriophage WO in Wolbachia, the Endosymbiont Causing Sexual Alterations in Arthropods. In: Journal of Molecular Evolution. Band 51, 2000, S. 491–497, doi:10.1007/s002390010112.
- ↑ Franck Dedeine, Fabrice Vavre, Frédéric Fleury, Benjamin Loppin, Michael E. Hochberg, Michel Boulétreau: Removing symbiotic Wolbachia bacteria specifically inhibits oogenesis in a parasitic wasp. In: Proceedings of the National Academy of Sciences of the United States of America. Band 98, Nr. 11, 2001, S. 6247–6252, doi:10.1073/pnas.101304298.
- ↑ Scott L. O'Neill, M. M. Pettigrew, S. P. Sinkins, H. R. Braig, T. G. Andreadis, R. B. Tesh: In vitro cultivation of Wolbachia pipientis in an Aedes albopictus cell line. In: Insect Molecular Biology. Band 6, Nr. 1, 1997, S. 33–39, doi:10.1046/j.1365-2583.1997.00157.x.
- ↑ a b c d e f Wieslaw J. Kozek, Ramakrishna U. Rao: The Discovery of Wolbachia in Arthropods and Nematodes – A Historical Perspective. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 1–14.
- ↑ a b c d Achim Hörauf, Sabine Mand, Dietrich W. Büttner: Doxycyclin zur Chemotherapie der Filariosen: Elimination von Wolbachien, essenziellen bakteriellen Endosymbionten in den Würmern. In: Deutsches Ärzteblatt. Band 100, Nr. 37. Deutscher Ärzte-Verlag, 12. September 2003, S. A2383-A2386 (aerzteblatt.de).
- ↑ Laura Kramer, John W. McCall, Giulio Grandi, Claudio Genchi: Wolbachia and Its Importance in Veterinary Filariasis. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 124–132.
- ↑ Katelyn Fenn, Mark Blaxter: Coexist, Cooperate and Thrive: Wolbachia as Long-Term Symbionts of Filarial Nematodes. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 66–76.
- ↑ a b Achim Hörauf, Kenneth Pfarr: Wolbachia Endosymbionts: An Achilles’ Heel of Filarial Nematodes. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. 31–51.
- ↑ Amélie v. Saint André, Nathan M. Blackwell, Laurie R. Hall, Achim Hörauf, Norbert W. Brattig, Lars Volkmann, Mark J. Taylor, Louise Ford, Amy G. Hise, Jonathan H. Lass, Eugenia Diaconu, Eric Pearlman: The Role of Endosymbiotic Wolbachia Bacteria in the Pathogenesis of River Blindness. In: Science. Band 295, Nr. 5561, 2002, S. 1892–1895, doi:10.1126/science.1068732.
- ↑ Ilaria Dorigatti, Clare McCormack, Gemma Nedjati-Gilani, Neil M. Ferguson: Using Wolbachia for dengue control: insights from modelling. In: Trends in parasitology. Band 34, Nr. 2, Februar 2018, ISSN 1471-4922, S. 102–113, doi:10.1016/j.pt.2017.11.002, PMID 29183717, PMC 5807169 (freier Volltext).
- ↑ Margie Mason: Wolbachia-Bakterien: Forscher infizieren Moskitos mit Dengue-Hemmer. 6. November 2013 (welt.de [abgerufen am 20. Juli 2019]).
- ↑ Fabio M. Gomes, Carolina Barillas-Mury: Infection of anopheline mosquitoes with Wolbachia: Implications for malaria control. In: PLoS Pathogens. Band 14, Nr. 11, 15. November 2018, ISSN 1553-7366, doi:10.1371/journal.ppat.1007333, PMID 30440032, PMC 6237385 (freier Volltext).
- ↑ Kampf gegen Tropenkrankheit: Mit Bakterien gegen Malaria-Mücken. In: Spiegel Online. 31. Mai 2016 (spiegel.de [abgerufen am 20. Juli 2019]).
- ↑ - Bakterien schützen vor Malaria. Abgerufen am 20. Juli 2019 (deutsch).
- ↑ Helen F. Cross, Melang Haarbrink, Gill Egerton, Maria Yazdanbakhsh, Mark J. Taylor: Severe reactions to filarial chemotherapy and release of Wolbachia endosymbionts into blood. In: The Lancet. Band 358, Nr. 9296, 2001, S. 1873–1875, doi:10.1016/S0140-6736(01)06899-4.
- ↑ Paul B. Keiser, Stacey M. Reynolds, Kwablah Awadzi, Eric A. Ottesen, Mark J. Taylor, Thomas B. Nutman: Bacterial Endosymbionts of Onchocerca volvulus in the Pathogenesis of Posttreatment Reactions. In: The Journal of Infectious Diseases. Band 185, Nr. 6, 2002, S. 805–811, doi:10.1086/339344.
- ↑ a b Marshall Hertig, S. Burt Wolbach: Studies on rickettsia-like microorganisms in insects. In: Journal of medical research. Band 44, Nr. 3, 1924, S. 329–374, Tafeln XXVII-XXX, PMC 2041761 (freier Volltext).
- ↑ a b Marshall Hertig: The Rickettsia, Wolbachia pipientis (gen. et sp.n.) and Associated Inclusions of the Mosquito, Culex pipiens. In: Parasitology. Band 28, Nr. 4, 1936, S. 453–486, doi:10.1017/S0031182000022666.
- ↑ Cornelius B. Philip: Comments on the classification of the order Rickettsiales. In: Canadian Journal of Microbiology. Band 2, Nr. 3, 1956, S. 261–270, doi:10.1139/m56-030.
- ↑ Anton Hördt, Marina García López, Jan P Meier-Kolthoff, Marcel Schleuning, Lisa-Maria Weinhold, Brian J Tindall, Sabine Gronow, Nikos C. Kyrpides, Tanja Woyke und Markus Göker: Analysis of 1,000+ Type-Strain Genomes Substantially Improves Taxonomic Classification of Alphaproteobacteria. In: Front Microbiol (2020) Band 11: S. 468. doi:10.3389/fmicb.2020.00468
- ↑ Familie Ehrlichiaceae (Stand 27. März 2021)
- ↑ Earl C. Suitor, Emilio Weiss: Isolation of a Rickettsialike Microorganism (Wolbachia persica, n. sp.) from Argas persicus (Oken). In: The Journal of Infectious Diseases. Band 108, Nr. 1, 1961, S. 95–106, JSTOR:30099293.
- ↑ Mark L. Niebylski, Mort G. Peacock, Elizabeth R. Fischer, Stephen F. Porcella, Tom G. Schwan: Characterization of an Endosymbiont Infecting Wood Ticks, Dermacentor andersoni, as a Member of the Genus Francisella. In: Applied and Environmental Microbiology. Band 63, Nr. 10, 1997, S. 3933–3940, PMC 168705 (freier Volltext).
- ↑ a b Kyung-Tai Min, Seymour Benzer: Wolbachia, normally a symbiont of Drosophila, can be virulent, causing degeneration and early death. In: Proceedings of the National Academy of Sciences of the United States of America. Band 94, Nr. 20, 1997, S. 10792–10796, doi:10.1073/pnas.94.20.10792.
- ↑ Catherine Hsiao, T. H. Hsiao: Rickettsia as the cause of cytoplasmic incompatibility in the alfalfa weevil, Hypera postica. In: Journal of Invertebrate Pathology. Band 45, Nr. 2, 1985, S. 244–246, doi:10.1016/0022-2011(85)90016-3.
- ↑ Ehsan Sanaei, Martin Husemann, Marjan Seiedy, Michael Rethwisch, Midori Tuda, Teodora B. Toshova, Min Jee Kim, Daniela Atanasova, Iksoo Kim: Global genetic diversity, lineage distribution, and Wolbachia infection of the alfalfa weevil Hypera postica (Coleoptera: Curculionidae). In: Ecology and Evolution. Band 9, Nr. 17, 2019, S. 9546–9563, doi:10.1002/ece3.5474.
- ↑ Yury Ilinsky, Oleg E. Kosterin: Molecular diversity of Wolbachia in Lepidoptera: Prevalent allelic content and high recombination of MLST genes. In: Molecular Phylogenetics and Evolution. Band 109, 2017, S. 164–169, doi:10.1016/j.ympev.2016.12.034.
- ↑ Guan-Hong Wang, Ling-Yi Jia, Jin-Hua Xiao, Da-Wei Huang: Discovery of a new Wolbachia supergroup in cave spider species and the lateral transfer of phage WO among distant hosts. In: Infection, Genetics and Evolution. Band 41, 2016, S. 1–7, doi:10.1016/j.meegid.2016.03.015.
- ↑ Michael Gerth: Classification of Wolbachia (Alphaproteobacteria, Rickettsiales): No evidence for a distinct supergroup in cave spiders. In: Infection, Genetics and Evolution. Band 43, 2016, S. 378–380, doi:10.1016/j.meegid.2016.05.034.
- ↑ Shamayim T. Ramírez-Puebla, Luis E. Servín-Garcidueñas, Ernesto Ormeño-Orrillo, Arturo Vera-Ponce de León, Mónica Rosenblueth, Luis Delaye, Julio Martínez, Esperanza Martínez-Romero: Species in Wolbachia? Proposal for the designation of ‘Candidatus Wolbachia bourtzisii’, ‘Candidatus Wolbachia onchocercicola’, ‘Candidatus Wolbachia blaxteri’, ‘Candidatus Wolbachia brugii’, ‘Candidatus Wolbachia taylori’, ‘Candidatus Wolbachia collembolicola’ and ‘Candidatus Wolbachia multihospitum’ for the different species within Wolbachia supergroups. In: Systematic and Applied Microbiology. Band 38, Nr. 6, 2015, S. 390–399, doi:10.1016/j.syapm.2015.05.005.
- ↑ Amelia R. I. Lindsey, Seth R. Bordenstein, Irene L. G. Newton, Jason L. Rasgon: Species in Wolbachia? Proposal for the designation of ‘Candidatus Wolbachia bourtzisii’, ‘Candidatus Wolbachia onchocercicola’, ‘Candidatus Wolbachia blaxteri’, ‘Candidatus Wolbachia brugii’, ‘Candidatus Wolbachia taylori’, ‘Candidatus Wolbachia collembolicola’ and ‘Candidatus Wolbachia multihospitum’ for the different species within Wolbachia supergroups. In: Systematic and Applied Microbiology. Band 38, Nr. 6, 2015, S. 390–399, doi:10.1016/j.syapm.2015.05.005.
- ↑ Shamayim T. Ramírez-Puebla, Luis E. Servín-Garcidueñas, Ernesto Ormeño-Orrillo, Arturo Vera-Ponce de León, Mónica Rosenblueth, Luis Delaye, Julio Martínez, Esperanza Martínez-Romero: A response to Lindsey et al. “Wolbachia pipientis should not be split into multiple species: A response to Ramírez-Puebla et al.” In: Systematic and Applied Microbiology. Band 39, Nr. 3, 2016, S. 223–225, doi:10.1016/j.syapm.2016.03.004.
- ↑ Laura Baldo et al.: Wolbachia are present in southern african scorpions and cluster with supergroup F. In: Current Microbiology 2007, Band 55, S. 367–373, doi:10.1007/s00284-007-9009-4.
- ↑ Ramakrishna U. Rao, Achim Hörauf: Foreword. In: Achim Hörauf, Ramakrishna U. Rao (Hrsg.): Wolbachia: A Bug’s Life in another Bug (= Heinz Zeichhardt, Brian W. J. Mahy [Hrsg.]: Issues in Infectious Diseases. Band 5). Karger, Basel u. a. 2007, ISBN 978-3-8055-8180-6, S. VII-VIII.