Alkylierte Ketendimere

Alkylierte Ketendimere oder Alkylketendimere (AKD) basieren auf dem viergliedrigen Ringsystem des 2-Oxetanons, das auch zentrales Strukturelement des Propiolactons und des Diketens ist. Am Oxetanring von technisch relevanten Alkylketendimeren befinden sich in 3-Position eine C12 – C16-Alkylgruppe und in 4-Position eine C13 – C17-Alkylidengruppe.
Die Hauptanwendung alkylierter Ketendimere liegt in der Masseleimung – auch als Schlichtung (engl. sizing) bezeichnet – von Papier, Pappe und Karton, sowie in der Hydrophobierung von Cellulosefasern. Die derart modifizierten Papierprodukte zeichnen sich durch höhere mechanische Festigkeiten und geringere Penetration von Wasser, Druckfarben oder Tinten aus.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Edgar Wedekind publizierte bereits 1901 die Synthese von Alkylketendimeren bei der Reaktion von Carbonsäurechloriden mit tertiären Aminen,[1] hielt die Umsetzungsprodukte jedoch für Polymere.[2]
Da die Molekulargewichtsbestimmungen der frühen Autoren immer auf ein Mehrfaches der Atomgruppierung R1R2CH=C=O hinwiesen, wurden z. B. für das Umsetzungsprodukt aus Isobutyrylchlorid und Triethylamin eine Diketonstruktur mit Cyclobutanring vorgeschlagen[3] bzw. aus Propionylchlorid und Tripropylamin ein so genanntes Pyronon postuliert.[4][5]

Die Identifizierung der primären Umsetzungsprodukte von Carbonsäurechloriden mit α-ständigen Wasserstoffatomen mit tertiären Aminen als Ketene durch Hermann Staudinger[6][7] und Norman Thomas Mortimer Wilsmore[8] und die Charakterisierung der Ketene als hochreaktive Verbindungen (Ethenone), die in einer dimerisierenden (2+2)-Cycloaddition 2-Oxetanone mit 4-ständiger Alkylidengruppe bilden, brachten allmählich Klarheit über die Konstitution der alkylierten Ketendimere.
Erschwert wurde die Konstitutionsaufklärung durch die unterschiedlichen Dimerisierungsprodukte von Ketenen. So dimerisiert das einfache Keten (H2C=C=O) zu Diketen (4-Methylen-2-oxetanon), während substituierte Ketene, wie das aus Isobutyrylchlorid mit Triethylamin gebildete Dimethylketen (Me2C=C=O), in einer Kopf-an-Schwanz-Addition zum 2,2,4,4-Tetramethyl-1,3-cyclobutandion dimerisiert.[3][9]

Das 2,2,4,4-Tetramethyl-1,3-cyclobutandion lässt sich leicht zu Dimethylketendimer (4-Isopropyliden-3,3-dimethyl-2-oxetanon) isomerisieren.[10]

Die Synthese und Charakterisierung von Hexadecylketendimer, einer Schlüsselsubstanz für in der Papierindustrie verwendete AKD wurde erstmals 1945 in einem Patent[11] und 1947 in einer Publikation[12] beschrieben.
Eine quantenchemische Betrachtung schließt die Bildung eines Cyclobutandions bei der Dimerisierung von n-Alkylketenen R-CH=C=O aus und favorisiert die Bildung der thermodynamisch stabilsten 2-Oxetanonstruktur.[13]
Herstellung
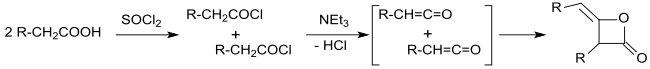
[Bearbeiten | Quelltext bearbeiten]Die industrielle Synthese von alkylierten Ketendimeren – damals noch als Ketoethenone bezeichnet – wurde 1945 aus langkettigen Carbonsäurechloriden in inerten Lösungsmitteln, wie z. B. Diethylether oder Benzol mit Triethylamin als tertiärem Amin unter wasserfreien Bedingungen patentiert.[11] Nach Abfiltrieren des unlöslichen Triethylaminhydrochlorids und Abdestillieren des Lösungsmittels werden langkettige Alkylketendimere in Ausbeuten bis über 90 % erhalten.

Der Einsatz anderer Lösungsmittel, wie z. B. Carbonsäureester oder Ketone zur leichteren Abtrennung der Trialkylamin-hydrochloride[14] oder anderer Amine, wie z. B. N,N,N',N'-Tetramethyl-1,6-hexandiamin[15] bringt keine entscheidenden Vorteile.
Verfahren ohne Verwendung von Lösungsmitteln sind ebenfalls beschrieben, wobei das entstehende Aminhydrochlorid entweder abfiltriert oder mit verdünnten wässrigen Säuren extrahiert wird.[16]
Ein kontinuierliches Verfahren, bei dem langkettiges Carbonsäurechlorid und tertiäres Amin, z. B. Dimethylisopropylamin, Dimethylcyclohexylamin oder Triethylamin ohne Lösungsmittel getrennt einem Rohrreaktor, einem Kneter oder bevorzugt einem Zweischneckenextruder oder Planetwalzenextruder zugeführt und bei Temperaturen zwischen 90 und 110 °C zur Reaktion gebracht wird, liefert bei kurzen Reaktionszeiten Lactongehalte über 90 %. Die Aufarbeitung erfolgt wiederum durch Phasentrennung oder saure Extraktion.[17]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Alkylierte Ketendimere als Papierleimungsmittel
[Bearbeiten | Quelltext bearbeiten]Die Probleme mit der seit dem frühen 19. Jahrhundert eingeführten sauren (Aluminiumsulfat-vermittelten) Masseleimung von Papier mit alkalisch aufgeschlossenen Kolophoniumharzen (s. auch Papierzerfall) führten neben der Verwendung von alkalischen Flockungsmitteln, wie z. B. Kreide oder Calciumcarbonat als so genannte Alkalireserve, zur Suche nach Alternativmaterialien zur Leimung im neutralen oder alkalischen Milieu. Neben den deutlich reaktiveren, aber in Gegenwart von Wasser schnell hydrolysierenden Alkenylbernsteinsäureanhydriden

haben sich die alkylierten Ketendimere – beginnend in den 1950er Jahren[18] – ab den 1960er Jahren als bevorzugte Oberflächen- und Masseleimungsmittel in der Papierindustrie durchgesetzt.
Industriell verwendete AKD leiten sich von Fettsäuren mit Kettenlängen zwischen C14 (Myristinsäure) bis C22 (Behensäure) ab; bevorzugt wird Palmityl(C16)diketen und Stearyl(C18)keten und deren Mischungen, sowie Fettsäuregemische aus der Hydrolyse tierischer und pflanzlicher Fette in der angegebenen Kettenlängenverteilung eingesetzt. Wegen der Kettenlänge der ursprünglichen Fettsäuren sind AKD wachsartige Feststoffe mit Schmelzpunkten zwischen 42 und ca. 70 °C, d. h. Mischungen aus alkylierten Ketendimeren und Wasser sind bei Temperaturen unter 40 °C Dispersionen, bei Temperaturen oberhalb 45 °C Emulsionen.
Wenig gebräuchlich sind flüssige AKD, basierend auf ungesättigten Fettsäuren, wie z. B. Ölsäure oder verzweigten Fettsäuren, wie z. B. Isostearinsäure.
Wässrige Alkyldiketendispersionen enthalten meist 10 – 20 Gew.% AKD, sowie auch als Retentionshilfsmittel aktive Schutzkolloide, besonders Polykationen, wie z. B. kationische Stärke, Copolymere aus N-Vinylpyrrolidon und quaterniertem 1-Vinylimidazol, acylierte Polyethylenimine[19] oder kationische hochmolekulare (Mittlere molare Masse bis 7 Mio. g/mol) Polyacrylamide (C-PAM) und weitere Stabilisatoren, meist anionische Tenside, wie z. B. Ligninsulfonate oder Kondensationsprodukte aus Naphthalinsulfonsäure-Natriumsalz und Formaldehyd.[20]
Derart stabilisierte AKD-Dispersionen sind bei Raumtemperatur bis zu drei Monaten aktiv und stabil und vertragen auch die Zugabe unterschiedlicher Füllstoffe für Papiere, Pappen oder Kartons, wie z. B. Kaolin, Kreide, Talkum, Titandioxid, Calciumsulfat, Aluminiumoxid usw. in Gewichtsanteilen von 5 bis 25 %.
Die zur Leimung von Papier und Papierprodukten eingesetzten Mengen an Alkylketendimer betragen vorzugsweise 0,15 bis 0,8 Gew.%, mitunter auch 0,05 bis 0,2 Gew.%,[17] bezogen auf den trockenen Papierstoff.
Papierleimung mit alkylierten Ketendimeren
[Bearbeiten | Quelltext bearbeiten]Für die Papierleimung mit AKD wurde ein dreistufiger Prozess vorgeschlagen, der trotz kontroverser Diskussionen in den 1990er Jahren am besten die ablaufenden Prozesse wiederzugeben und die erzielten Ergebnisse zu erklären scheint.[21] Entscheidende Kriterien für die Güte der Hydrophobierung von Papieren sind
1. die Retention, d. h. die Rückhaltung der AKD-Partikel auf der feuchten Papiermasse auf dem Papiersieb
2. die Spreitung, d. h. die Ausbreitung der AKD-Partikel auf der Oberfläche und die Durchdringung der Papiermasse
3. die chemische Reaktion der Hydroxygruppen der Cellulose (Veresterung) mit den alkylierten Ketendimeren unter Ausbildung von beta-Ketocarbonsäure-Estern.

Ad 1. Entscheidend sind hier der molekulare Aufbau, d. h. molare Masse und Vernetzungsgrad, die chemische Natur, d. h. die molare Ladungsdichte an kationischen Gruppen, die exakte Dosierung des kationischen Polymers als Dispersionsstabilisator und Retentionshilfsmittel, sowie die Einhaltung der sonstigen Prozessparameter, wie Temperatur, pH-Wert und Verweilzeiten.
Ad 2. Nach Entfernen des überschüssigen Wassers – auch zur Vermeidung der Hydrolyse des AKD zur beta-Ketosäure und anschließender Decarboxylierung zum Keton –

erfolgt das Aufbrechen der stabilisierten AKD-Partikel auf der Rohpapiermasse, das Aufschmelzen des festen AKD-Wachses (bei ca. 90 °C), das Spreiten des flüssigen AKD-Wachses durch Oberflächendiffusion auf den Cellulosefasern und die Ausbildung möglichst geschlossener hydrophober Schichten, deren Dicke von der AKD-Konzentration in der Dispersion abhängt.[22]
Ad 3. Die Hydrophobierung von Cellulosefasern mit alkylierten Ketendimeren erfolgt am effektivsten im neutralen, bevorzugt schwach alkalischen (pH-Wert 7,5 – 9,0) Milieu. Die Reaktionstemperatur beträgt meist 90–110 °C, wobei ungefähr 40 % des eingesetzten AKD mit der Cellulose reagiert.[21] Die nach der Reaktion gemessenen Kontaktwinkel von > 100° weisen auf den hydrophoben Charakter der AKD-modifizierten Modelloberflächen hin. Die Veresterung von Hydroxygruppen von Cellulosefasern konnte auch durch Vergleichsreaktionen mit 14C-markierten AKD nachgewiesen werden.[21]
Die Leimung mit AKD eignet sich für die dauerhafte Hydrophobierung von Zeitungs-, Druck- und Schreibpapieren und von Kartons als Behälter für Flüssigkeiten (auch für Lebensmittel, wie z. B. Milch), sowie für die Verbesserung der Formstabilität von Papierprodukten und der Laufeigenschaften von Papiermaschinen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- J.C. Roberts: Paper Chemistry, 2nd Edition. Hrsg.: J.C. Roberts. Chapman & Hall, London 1996, ISBN 0-7514-0236-2.
- D. Johnson: Applications of Wet-End Paper Chemistry, 2nd Edition. Hrsg.: I. Thorn, C.O. Au. Springer Netherlands, 2009, ISBN 978-1-4020-6037-3, S. 73–112.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ E. Wedekind: Ueber die Gewinnung von Säurechloriden mit Hülfe von tertiären Aminen. In: Ber. Dtsch. Chem. Ges. Band 34, Nr. 2, 1901, S. 2070–2077, doi:10.1002/cber.19013402122.
- ↑ E. Wedekind: Ueber das Verhalten einiger Säurechloride bei der Chlorwasserstoffentziehung. In: Liebigs Ann. Chem. Band 323, Nr. 2, 1902, S. 246–257, doi:10.1002/jlac.19023230206.
- ↑ a b E. Wedekind, W. Weisswange: Ueber die Synthese eines Diketons der Cyclobutanreihe. In: Ber. Dtsch. Chem. Ges. Band 39, Nr. 2, 1906, S. 1631–1646, doi:10.1002/cber.19060390287.
- ↑ E. Wedekind, J. Haeussermann: Pyrononsynthesen mit Hilfe der Tertiärbasenreaktion I. In: Ber. Dtsch. Chem. Ges. Band 41, Nr. 2, 1908, S. 2297–2302, doi:10.1002/cber.190804102135.
- ↑ E. Wedekind, J. Häussermann, W. Weisswange, M. Müller: Pyrononsynthesen mit Hilfe der Tertiärbasenreaktion II. In: Liebigs Ann. Chem. Band 378, Nr. 3, 1911, S. 261–292, doi:10.1002/jlac.19113780302.
- ↑ H. Staudinger: Ketene, eine neue Körperklasse. In: Ber. Dtsch. Chem. Ges. Band 38, Nr. 2, 1905, S. 1735–1739, doi:10.1002/cber.19050380283.
- ↑ H. Staudinger, H.W. Klever: Über Ketene. 5. Mitteilung. Reaktionen des Dimethylketens. In: Ber. Dtsch. Chem. Ges. Band 40, Nr. 1, 1907, S. 1149–1153, doi:10.1002/cber.190704001170.
- ↑ N.T.M. Wilsmore, A.W. Stewart: Keten. Bemerkungen zu der Abhandlung der HHrn. Staudinger und Klever. In: Ber. Dtsch. Chem. Ges. Band 41, Nr. 1, 1908, S. 1025–1027, doi:10.1002/cber.190804101202.
- ↑ R. Huisgen, P. Otto: The mechanism of dimerization of dimethylketene. In: J. Am. Chem. Soc. Band 90, Nr. 19, 1968, S. 5342–5343, doi:10.1021/ja.01021a090.
- ↑ R.H. Hasek, R.D. Clark, G.L. Mayberry: DIMETHYLKETENE β-LACTONE DIMER In: Organic Syntheses. 48, 1968, S. 72, doi:10.15227/orgsyn.048.0072; Coll. Vol. 5, 1973, S. 1103 (PDF).
- ↑ a b Patent US2369919: Ketoethenones and process therefor. Angemeldet am 13. Oktober 1938, veröffentlicht am 20. Februar 1945, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: J.C. Sauer.
- ↑ J.C. Sauer: Ketene dimers from acid chlorides. In: J. Am. Chem. Soc. Band 69, Nr. 10, 1947, S. 2444–2448, doi:10.1021/ja.01202a058.
- ↑ Z. Zhang, G. Li, G. Hu, Y. Sun: Theoretical research on the mechanism of the dimerization reaction of alkyl ketenes. In: J. Chem. Band 2013, 2013, doi:10.1155/2013/481586.
- ↑ Patent US5484952: Process for the manufacture of alkyl ketene dimer. Angemeldet am 5. Mai 1994, veröffentlicht am 16. Januar 1996, Anmelder: Hercules Inc., Erfinder: T.F. Nolan, B.M. Stubbs.
- ↑ Patent US7960497B2: Preparation of alkyl ketene dimers. Angemeldet am 3. Januar 2007, veröffentlicht am 14. Juni 2011, Anmelder: Hercules Inc., Erfinder: D.A. Gerstenhaber.
- ↑ Patent US5344943: Long-chain ketene dimers. Angemeldet am 29. Dezember 1992, veröffentlicht am 6. September 1994, Anmelder: Akzo Nobel B.V., Erfinder: N. Brolund.
- ↑ a b Patent WO03045936A1: Method for producing alkyl ketene dimers. Angemeldet am 19. November 2002, veröffentlicht am 5. Juni 2003, Anmelder: BASF AG, Erfinder: R. Ettl, M. Winter, T. Freund, T. Kessler, G. Grimm.
- ↑ Patent US2627477: Higher alkyl ketene dimer emulsion. Angemeldet am 6. Oktober 1949, veröffentlicht am 3. Februar 1953, Anmelder: Hercules Powder Co., Erfinder: W.F. Downey.
- ↑ Patent WO9626318: Aqueous alkyldiketene dispersions and the use thereof as glue for paper. Angemeldet am 7. Februar 1996, veröffentlicht am 29. August 1996, Anmelder: BASF AG, Erfinder: R. Ettl, P. Lorencak, G. Scherr, W. Reuther, G. Glas.
- ↑ Patent WO2007141197A1: Aqueous alkylketene dimer dispersions. Angemeldet am 1. Juni 2007, veröffentlicht am 13. Dezember 2007, Anmelder: BASF AG, Erfinder: C. Hamers, A. Brockmeyer, M. Schmid, K. Lorenz, U. Riebeling.
- ↑ a b c T. Lindström, T. Larsson: A note on AKD-sizing: an investigation of real and apparent contradictions in literature regarding spreadin/diffusion of AKD on cellulose, Report no. 81. Hrsg.: STFI-Packfors. 2005 (innventia.com [PDF]).
- ↑ J. Lindfors, J. Sahmi, J. Laine, P. Stenius: AKD and ASA model surfaces: preparation and characterization. In: BioResources. Band 2, Nr. 4, 2007, S. 652–670 (ncsu.edu [PDF; 938 kB]).