„Phasengrenzlinie“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Koexistenzkurve als Synonym zum Lemma Phasengrenzlinie ergänzt. |
Einzelnachweis ergänzt. |
||
| Zeile 16: | Zeile 16: | ||
*Bezeichnung der Zustände während des Phasenübergangs: [[Kondensationspunkt (Physik)|Kondensationspunkt]]/​Kondensationsbereich |
*Bezeichnung der Zustände während des Phasenübergangs: [[Kondensationspunkt (Physik)|Kondensationspunkt]]/​Kondensationsbereich |
||
'''Übergänge Flüssigkeit → Gas und Gas → Flüssigkeit bei [[Reinstoff|Reinstoffen]]:''' |
'''Übergänge Flüssigkeit → Gas und Gas → Flüssigkeit bei [[Reinstoff|Reinstoffen]]:''' |
||
*'''Dampfdruckkurve'''<ref>{{Literatur |Autor=Schmidt, Joachim. |Titel=Einstieg in die Physikalische Chemie für Nebenfächler |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=3., überarbeitete und erweiterte Auflage |Verlag=Vieweg+Teubner Verlag / GWV Fachverlage GmbH, Wiesbaden |Ort=Wiesbaden |Datum=2009 |ISBN=978-3-8348-9256-0 |Seiten=S. 31 |Online=https://www.worldcat.org/oclc/605299513 |Abruf=2021-01-31}}</ref> |
|||
*'''Dampfdruckkurve''' |
|||
*Bezeichnung der Phasenübergänge: Verdampfen/Sieden und Kondensation |
*Bezeichnung der Phasenübergänge: Verdampfen/Sieden und Kondensation |
||
*Eine Dampfdruckkurve ist eine Projektion der Siedekurve und der Kondensationskurve aus der [[P-v-T-Diagramm|Druck-Volumen-Temperatur-Zustandsfläche]] in die Druck-Temperatur-Ebene. Da bei miteinander im Gleichgewicht stehenden koexistierenden Phasen Druck und Temperatur dieselben Werte annehmen müssen,<ref name="Denbigh_184">Kenneth Denbigh: ''The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering''. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, [[doi:10.1017/CBO9781139167604]], S. 184.</ref> liegen Siedekurve und Kondensationskurve in der Druck-Temperatur-Ebene übereinander und erscheinen als Linie, die Tripelpunkt und kritischen Punkt verbindet. Die Dampfduckkurve ist daher eine Projektion des Koexistenzgebietes der Gasphase und der flüssigen Phase in die Druck-Temperatur-Ebene. |
*Eine Dampfdruckkurve ist eine Projektion der Siedekurve und der Kondensationskurve aus der [[P-v-T-Diagramm|Druck-Volumen-Temperatur-Zustandsfläche]] in die Druck-Temperatur-Ebene. Da bei miteinander im Gleichgewicht stehenden koexistierenden Phasen Druck und Temperatur dieselben Werte annehmen müssen,<ref name="Denbigh_184">Kenneth Denbigh: ''The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering''. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, [[doi:10.1017/CBO9781139167604]], S. 184.</ref> liegen Siedekurve und Kondensationskurve in der Druck-Temperatur-Ebene übereinander und erscheinen als Linie, die Tripelpunkt und kritischen Punkt verbindet. Die Dampfduckkurve ist daher eine Projektion des Koexistenzgebietes der Gasphase und der flüssigen Phase in die Druck-Temperatur-Ebene. |
||
Version vom 31. Januar 2021, 18:34 Uhr



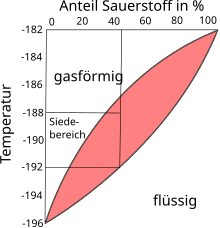
Unter einer Phasengrenzlinie oder Koexistenzkurve versteht man eine Linie im Zustandsraum eines thermodynamischen Systems, an der zumindest zwei koexistierende Phasen miteinander im thermodynamischen Gleichgewicht stehen, so dass deren chemische Potentiale dort jeweils denselben Wert aufweisen.[1] Überschreitet ein thermodynamisches System eine Phasengrenzlinie, durchläuft es einen Phasenübergang. An bestimmten herausgehobenen Punkten innerhalb des Zustandsraums, wie etwa an Tripelpunkten und eutektischen Punkten, treffen mehrere Phasengrenzlinien aufeinander. Phasengrenzlinien, die in der Zustandsfläche des betrachteten thermodynamischen Systems Koexistenzgebiete umschließen, innerhalb derer im Gleichgewicht koexistierende Phasen vorliegen, werden als Binodalen bezeichnet und können kritische Punkte aufweisen. Beispiele für Phasengrenzlinien und die zugehörigen Phasenübergänge:
Flüssigkeit → Gas:
- Siedekurve; Synonyme: Siedelinie, Siedepunktskurve, Siededruckkurve und Siedepunktkurve
- Bezeichnung des Phasenübergangs: Verdampfen (auch Sieden)
- Bezeichnung der Zustände während des Phasenübergangs: Siedepunkte/Siedebereich
- Der Verlauf der Siedepunktskurve lässt sich durch die Clausius-Clapeyron-Gleichung errechnen.
Gas → Flüssigkeit:
- Kondensationskurve; Synonyme: Kondensationslinie, (für Wasser auch Taulinie, Taukurve, Taupunktkurve, Taupunktlinie)
- Bezeichnung des Phasenübergangs: Kondensation
- Bezeichnung der Zustände während des Phasenübergangs: Kondensationspunkt/Kondensationsbereich
Übergänge Flüssigkeit → Gas und Gas → Flüssigkeit bei Reinstoffen:
- Dampfdruckkurve[2]
- Bezeichnung der Phasenübergänge: Verdampfen/Sieden und Kondensation
- Eine Dampfdruckkurve ist eine Projektion der Siedekurve und der Kondensationskurve aus der Druck-Volumen-Temperatur-Zustandsfläche in die Druck-Temperatur-Ebene. Da bei miteinander im Gleichgewicht stehenden koexistierenden Phasen Druck und Temperatur dieselben Werte annehmen müssen,[3] liegen Siedekurve und Kondensationskurve in der Druck-Temperatur-Ebene übereinander und erscheinen als Linie, die Tripelpunkt und kritischen Punkt verbindet. Die Dampfduckkurve ist daher eine Projektion des Koexistenzgebietes der Gasphase und der flüssigen Phase in die Druck-Temperatur-Ebene.
Feststoff → Flüssigkeit:
- Schmelzkurve; Synonyme: Schmelzlinie, Schmelzpunktskurve, Schmelzdruckkurve
- Bezeichnung des Phasenübergangs: Schmelzen
- Bezeichnung der Zustände während des Phasenübergangs: Schmelzpunkt/Schmelzbereich
Flüssigkeit → Feststoff:
- Erstarrungskurve; Synonyme: Erstarrungslinie, Gefrierpunktskurve, Gefrierpunktslinie
- Bezeichnung des Phasenübergangs: Gefrieren
- Bezeichnung der Zustände während des Phasenübergangs: Gefrierpunkt/Gefrierbereich
Feststoff → Gas:
- Sublimationskurve; Synonyme: Sublimationslinie
- Bezeichnung des Phasenübergangs: Sublimation
- Bezeichnung der Zustände während des Phasenübergangs: Sublimationspunkt/Sublimationsbereich
Gas → Feststoff:
- Resublimationskurve
- Bezeichnung des Phasenübergangs: Resublimation
- Bezeichnung der Zustände während des Phasenübergangs: Resublimationspunkt/Resublimationsbereich
Entmischung:
- Die bei Entmischung einer homogenen Mischphase zu überquerende Phasengrenzlinie wird üblicherweise als Binodale bezeichnet, ohne dabei die Art des Phasenüberganges näher zu spezifizieren.
Einzelnachweise
- ↑ Peter W. Atkins, Julio de Paula: Physikalische Chemie. Aus dem Englischen von Michael Bär, Anna Schleitzer und Carsten Heinisch. 5. Auflage. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33247-2, Kapiten "4.1.2 Phasengrenzen"
- ↑ Schmidt, Joachim.: Einstieg in die Physikalische Chemie für Nebenfächler. 3., überarbeitete und erweiterte Auflage. Vieweg+Teubner Verlag / GWV Fachverlage GmbH, Wiesbaden, Wiesbaden 2009, ISBN 978-3-8348-9256-0, S. 31 (worldcat.org [abgerufen am 31. Januar 2021]).
- ↑ Kenneth Denbigh: The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, doi:10.1017/CBO9781139167604, S. 184.