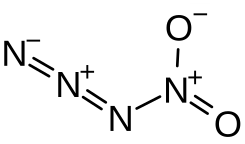
Nitrylazid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Nitrylazid | ||||||
| Andere Namen |
| ||||||
| Summenformel | N4O2 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 88,03 g·mol−1 | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
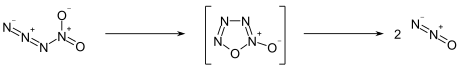
Nitrylazid (Tetrastickstoffdioxid) ist ein instabiles Stickoxid, das sowohl als anorganisches kovalentes Azid als auch Nitrylverbindung gesehen werden kann. Der Stickstoffgehalt im Molekül beträgt 63,65 %.
Darstellung und Gewinnung[Bearbeiten | Quelltext bearbeiten]
Ein erster Hinweis auf die Bildung der Verbindung aus Nitroniumtetrafluoroborat und Lithiumazid in Acetonitril oder Tetrachlorkohlenstoff bei tiefen Temperaturen wurde schon 1973 gefunden.[2] Umsetzungen von Nitrylchlorid mit Aziden wie Trimethylsilylazid oder Titandicyclopentanyldiazid ergaben statt der Zielverbindung bevorzugt das Chlorazid ClN3.[3] Die Reaktion von Natriumazid mit Nitrylfluorid führte schon bei −115 °C zu einem explosionsartigen Zerfall der Reaktionsmischung.[3] Eine Darstellung von Nitrylazid gelang durch die Umsetzung von Nitroniumhexafluoroantimonat mit Natriumazid in flüssigem Kohlendioxid bei −50 °C unter Druck, wobei die Verbindung nur spektroskopisch nachgewiesen und nicht isoliert wurde.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Nitrylazid ist so instabil, dass eine Reindarstellung nicht möglich ist. Das in Lösung gemessene Raman-Spektrum stimmt mit dem mittels Ab-initio-Berechnung ermittelten überein.[3] Die Verbindung zerfällt leicht zum Distickstoffmonoxid, wobei eine zyklische Zwischenstufe postuliert wird.[2] Eine quantenchemische Ab-initio-Berechnung ergab für den Zerfall eine stark exotherme molare Reaktionsenthalpie von −250 kJ·mol−1.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Doyle, M.P.; Maciejko, J.J.; Busman, S.C.: Reaction between azide and nitronium ions, formation and decomposition of nitryl azide in J. Am. Chem. Soc. 95 (1973) 952–953, doi:10.1021/ja00784a069.
- ↑ a b c d e Klapötke, T.M.; Schulz, A.; Tornieporth-Oetting, C.: Studies of the Reaction Behavior of Nitryl Compounds Towards Azides: Evidence for Tetranitrogen Dioxide, N4O2 in Chem. Ber. 127 (1994) 2181–2185, doi:10.1002/cber.1491271115.