Ziegler-Synthesen
Die Ziegler-Synthesen sind chemisch-technische Verfahren im Bereich der Organischen Chemie. Sie sind benannt nach dem deutschen Chemiker Karl Ziegler (1898–1973).[1] Sie können eingeteilt werden in:
- das Ziegler-Direktverfahren,
- die Ziegler-Alfen-Synthese und
- die Ziegler-Alfol-Synthese.
Wichtige Folgeprodukte der synthetisierten Verbindungen sind beispielsweise Waschmittel und Körperpflegeprodukte.
1953 bemerkte Ziegler, dass sich mit Hilfe von Trialkylaluminiumvebindungen ausgehend von Alkenen geradzahlige Oligomere herstellen ließen. Heute werden Polyolefine (z. B. Polyethylen) technisch vorwiegend nach diesem Verfahren hergestellt.
Ziegler-Direktverfahren[Bearbeiten | Quelltext bearbeiten]
Das Ziegler-Direktverfahren dient zur Synthese von Triethylaluminium. Dies geschieht durch einen Kreisprozess in zwei Reaktionsschritten. Im ersten Schritt wird das angestrebte Produkt Triethylaluminium sogar als Edukt eingesetzt, welches mit Aluminium und Wasserstoff zu Diethylalumniumhydrid reagiert. Diese Reaktion wird Vermehrung genannt, wobei es zu einer Umlagerung von Ethylgruppen kommt. Die Reaktionsgleichung lautet:[2]

Beim zweiten Schritt des Direktverfahrens wird Diethylaluminiumhydrid mit Ethen umgesetzt und es entsteht wieder Triethylaluminium. Dieser Schritt wird Anlagerung genannt und durch folgende Reaktionsgleichung beschrieben:[2]

Werden die beiden Reaktionen zusammenbetrachtet, findet eine Vermehrung des Triethylaluminiums statt und es ergibt sich die Bruttogleichung des Verfahrens zu:[2]

Ziegler-Aufbaureaktion[Bearbeiten | Quelltext bearbeiten]
Die nachfolgende Abbildung zeigt den Mechanismus der Ziegler-Aufbau-Reaktion anhand des Einschubs von Ethen:

Die Reaktion findet dabei als gelenkte Kettenwachstumsreaktion statt, bei dem stückweise mehrere Etheneinheiten in die Alkylreste des Triethylaluminiums (1) „eingeschoben“ werden. Das Kettenwachstum geht so lange voran, bis die Verdrängungsreaktion einsetzt. (s. Ziegler-Alfen Reaktion) Die Kettenlänge beträgt dabei zwischen 10 und 20 Kohlenstoffatome. Setzt man statt Ethen entweder Propen oder Buten ein, setzt die Verdrängungsreaktion bereits nach der Dimerisierung ein.[3]
Ziegler-Alfen-Reaktion[Bearbeiten | Quelltext bearbeiten]
Der folgende Mechanismus zeigt die im oberen Abschnitt bereits erwähnte Verdrängungsreaktion in einer zweistufigen Variante:
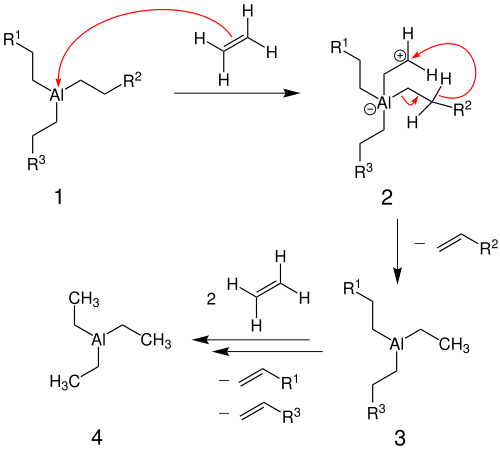
Dabei werden die in der Ziegler-Aufbau-Reaktion gebildeten Trialkylaluminium-Moleküle (1) weiterhin mit Ethen umgesetzt, allerdings bei wesentlich höheren Temperaturen. Dadurch bildet sich der Übergangszustand (2). In einem nächsten Schritt kommt es zu einer Umlagerung eines Wasserstoffatoms und dadurch zur Abspaltung des längerkettigen Alkylrestes. Dieser Prozess wird in der Industrie durch zwei verschiedene Varianten umgesetzt.
Die erste Variante ist eine zweistufige Variante, bei der die Reaktion in zwei verschiedenen Reaktoren ablaufen. Bei diesem kann der Katalysator durch Aufbereitung weiterhin eingesetzt werden.
In einer anderen Variante findet die Umwandlung einstufig statt. Hier werden nur katalytische Mengen Triethylaluminium eingesetzt und die Temperatur wird schon während des Kettenaufbaus höher gewählt. Die Ausbeute an unverzweigten α-Olefinen wird so erhöht. Bei dieser Variante kann der Katalysator nicht erneut verwendet werden, sondern ist zerstört.[3]
Ziegler-Alfol-Synthese[Bearbeiten | Quelltext bearbeiten]
Der unten stehende Mechanismus zeigt die Reaktion der Ziegler-Alfol-Synthese im Anschluss an die Ziegler-Aufbau-Reaktion:
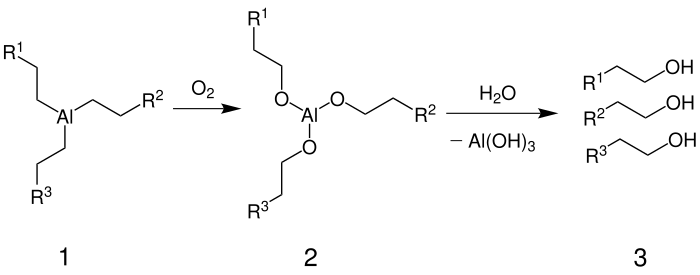
In dieser Synthese findet im ersten Schritt eine Umwandlung zu Aluminiumalkoxiden (2) statt. Entscheidend hierbei ist, dass stark getrocknete Luft verwendet wird, da ansonsten viele Nebenprodukte wie Ester, Ether, Säuren und Aldehyde auftauchen und die Ausbeute sinkt. In einem zweiten Schritt findet eine Verseifung durch Wasser statt, wobei die gewünschten Alkohole (3) und Aluminiumhydroxid entstehen.[2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Jürgen Falbe, Manfred Regitz (Hrsg.): Römpp Chemie Lexikon, 9. Auflage, Georg Thieme Verlag, Stuttgart 1990, ISBN 3-13-735109-X, S. 5129.
- ↑ a b c d Klaus Weissermel, Hans-Jürgen Arpe: Industrielle Organische Chemie, 5. Auflage, Wiley-VCH Verlag GmbH, Weinheim 1998, ISBN 3-527-28856-2, S. 232–233.
- ↑ a b Klaus Weissermel, Hans-Jürgen Arpe: Industrielle Organische Chemie, 5. Auflage, Wiley-VCH Verlag GmbH, Weinheim 1998, ISBN 3-527-28856-2, S. 83–85.