„Steroid-17α-Hydroxylase“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Ayacop (Diskussion | Beiträge) K t<po |
Ayacop (Diskussion | Beiträge) 17,20-Lyase ergänzt |
||
| Zeile 24: | Zeile 24: | ||
| TCDB = |
| TCDB = |
||
| TranspText = |
| TranspText = |
||
| MoreEC1 = {{ Infobox Protein/MoreEC |
|||
| EC-Nummer = 1.14.99.9 |
| EC-Nummer = 1.14.99.9 |
||
| Kategorie = Monooxygenase |
| Kategorie = Monooxygenase |
||
| Peptidase_fam = |
|||
| ⚫ | |||
| Inhibitor_fam = |
|||
| Substrat = Steroid + AH<sub>2</sub> + O<sub>2</sub> |
|||
| ⚫ | |||
| |
| Produkte = 17alpha-Hydroxysteroid + A + H<sub>2</sub>O |
||
}} |
|||
| ⚫ | |||
| MoreEC2 = {{ Infobox Protein/MoreEC |
|||
| EC-Nummer = 4.2.1.30 |
|||
| Kategorie = Lyase |
|||
| Reaktionsart = [[Deacetylierung]] |
|||
| ⚫ | |||
| Produkte = 17-Keto-Steroid + Essigsäure |
|||
}} |
|||
| Homolog_db = |
| Homolog_db = |
||
| Homolog_fam = |
| Homolog_fam = |
||
| Zeile 37: | Zeile 44: | ||
| Orthologe = |
| Orthologe = |
||
}} |
}} |
||
Die '''Steroid-17alpha-Hydroxylase''' (auch: '''Cytochrom P450 17A1 (CYP17A1)''') ist das [[Enzym]], das in [[Eukaryoten]] die [[Hydroxylierung]] von [[Steroide]]n an der 17-Position [[Katalyse|katalysiert]]. Diese Reaktion ist nicht nur für die Biosynthese der Hormone [[Dehydroepiandrosteron]] (DHEA) und [[Androstendion]] (ASD) notwendig, sondern auch beim Abbau von Steroiden ([[Biotransformation]]). Das Enzym ist wahrscheinlich ein Membranprotein. [[Mutation]]en im ''CYP17A1''-[[Gen]] sind die Ursache für [[adrenogenitales Syndrom]] Typ 5.<ref>{{UniProt|P05093}}</ref> |
Die '''Steroid-17alpha-Hydroxylase''' (auch: '''Cytochrom P450 17A1 (CYP17A1)''') ist das [[Enzym]], das in [[Eukaryoten]] die [[Hydroxylierung]] und anschließende [[Deacetylierung]] von [[Steroide]]n an der 17-Position [[Katalyse|katalysiert]]. Diese Reaktion ist nicht nur für die Biosynthese der Hormone [[Dehydroepiandrosteron]] (DHEA) und [[Androstendion]] (ASD) notwendig, sondern auch beim Abbau von Steroiden ([[Biotransformation]]). Das Enzym ist wahrscheinlich ein Membranprotein. [[Mutation]]en im ''CYP17A1''-[[Gen]] sind die Ursache für [[adrenogenitales Syndrom]] Typ 5.<ref>{{UniProt|P05093}}</ref> |
||
== Katalysierte Reaktionen == |
== Katalysierte Reaktionen == |
||
Die hauptsächlich katalysierte Reaktion ist die Hydroxylierung: |
|||
[[Datei:Progesteron.svg|160px|Progesteron]] + '''A'''H<sub>2</sub> + O<sub>2</sub> |
[[Datei:Progesteron.svg|160px|Progesteron]] + '''A'''H<sub>2</sub> + O<sub>2</sub> <math>\mathrm{\ \longrightarrow \ }</math> [[Datei:17alpha-Hydroxyprogesteron.svg|170px|17alpha-Hydroxyprogesteron]] + '''A''' + H<sub>2</sub>O |
||
Als Beispiel ist die 17-Hydroxylierung von Progesteron zu 17α-Hydroxyprogesteron gezeigt. Auch Pregnenolon wird so hydroxyliert. Unter bestimmten Bedingungen wie Phosphorylierung des Enzyms und Vorhandenseins von genügend Elektronen kann [[Essigsäure]] abgespalten werden. Diese Reaktion heißt ''17-α-Hydroxyprogesteron-Aldolase'' (kurz: '''17,20-Lyase''') und findet am gleichen Zentrum wie die Hydroxylierung statt. Wie bei der Hydroxylierung kann auch das Pregnenolonderivat als Substrat herhalten:<ref>{{Literatur | Autor=Bernhard Kleine | Titel=Hormone und Hormonsystem | Auflage=2. | Verlag=Springer | Ort=Berlin | Jahr=2010 | ISBN=978-3-642-00901-3 }}</ref><ref>{{cite journal |author=Bhangoo A, Aisenberg J, Chartoffe A, ''et al.'' |title=Novel mutation in cytochrome P450c17 causes complete combined 17alpha-hydroxylase/17,20-lyase deficiency |journal=J. Pediatr. Endocrinol. Metab. |volume=21 |issue=2 |pages=185–90 |year=2008 |month=February |pmid=18422032 |doi= |url=}}</ref> |
|||
Als Beispiel ist die 17-Hydroxylierung von Progesteron zu 17α-Hydroxyprogesteron gezeigt. |
|||
[[Datei:17alpha-Hydroxypregnenolon.svg|170px|17alpha-Hydroxypregnenolon]]<math>\mathrm{\longrightarrow CH_3COOH \ + \ }</math>[[Datei:Dehydroepiandrosteron.svg|160px|Dehydroepiandrosteron]] |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
| Zeile 48: | Zeile 58: | ||
== Weblinks == |
== Weblinks == |
||
{{Wikibooks|Biochemie und Pathobiochemie: |
{{Wikibooks|Biochemie und Pathobiochemie: Steroidhomon-Stoffwechsel}} |
||
*Jassal / reactome: ''[http://www.reactome.org/cgi-bin/link?SOURCE=Reactome&ID=REACT_9993 Hydroxylation of pregnenolone to form 17alpha-hydroxypregnenolone]'' |
*Jassal / reactome: ''[http://www.reactome.org/cgi-bin/link?SOURCE=Reactome&ID=REACT_9993 Hydroxylation of pregnenolone to form 17alpha-hydroxypregnenolone]'' |
||
*Jassal / reactome: ''[http://www.reactome.org/cgi-bin/link?SOURCE=Reactome&ID=REACT_10026 Side chain cleavage of 17alpha-hydroxyprenenolone to yield DHA]'' |
*Jassal / reactome: ''[http://www.reactome.org/cgi-bin/link?SOURCE=Reactome&ID=REACT_10026 Side chain cleavage of 17alpha-hydroxyprenenolone to yield DHA]'' |
||
*Jassal / reactome: ''[http://www.reactome.org/cgi-bin/link?SOURCE=Reactome&ID=REACT_10116 Hydroxylation of progesterone to form 17alpha-hydroxyprogesterone]'' |
|||
*Jassal / reactome: ''[http://www.reactome.org/cgi-bin/link?SOURCE=Reactome&ID=REACT_10113 Side chain cleavage of 17alpha-hydroxyprogesterone to yield 4-androstene-3,17-dione]'' |
|||
[[Kategorie:Lyase]] |
|||
[[Kategorie:Oxygenase]] |
[[Kategorie:Oxygenase]] |
||
[[Kategorie:Steroidhormonbiosynthese]] |
[[Kategorie:Steroidhormonbiosynthese]] |
||
Version vom 24. April 2010, 09:45 Uhr
| Steroid-17α-Hydroxylase | ||
|---|---|---|
|
Vorhandene Strukturdaten: 2C17 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 508 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name | CYP17A1 | |
| Externe IDs | ||
| Enzymklassifikationen | ||
| EC, Kategorie | 1.14.99.9, Monooxygenase | |
| Reaktionsart | Hydroxylierung | |
| Substrat | Steroid + AH2 + O2 | |
| Produkte | 17alpha-Hydroxysteroid + A + H2O | |
| EC, Kategorie | 4.2.1.30, Lyase | |
| Reaktionsart | Deacetylierung | |
| Substrat | 17alpha-Hydroxysteroid | |
| Produkte | 17-Keto-Steroid + Essigsäure | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Eukaryoten[1] | |
Die Steroid-17alpha-Hydroxylase (auch: Cytochrom P450 17A1 (CYP17A1)) ist das Enzym, das in Eukaryoten die Hydroxylierung und anschließende Deacetylierung von Steroiden an der 17-Position katalysiert. Diese Reaktion ist nicht nur für die Biosynthese der Hormone Dehydroepiandrosteron (DHEA) und Androstendion (ASD) notwendig, sondern auch beim Abbau von Steroiden (Biotransformation). Das Enzym ist wahrscheinlich ein Membranprotein. Mutationen im CYP17A1-Gen sind die Ursache für adrenogenitales Syndrom Typ 5.[2]
Katalysierte Reaktionen
Die hauptsächlich katalysierte Reaktion ist die Hydroxylierung:
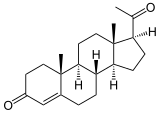 + AH2 + O2
+ AH2 + O2  + A + H2O
+ A + H2O
Als Beispiel ist die 17-Hydroxylierung von Progesteron zu 17α-Hydroxyprogesteron gezeigt. Auch Pregnenolon wird so hydroxyliert. Unter bestimmten Bedingungen wie Phosphorylierung des Enzyms und Vorhandenseins von genügend Elektronen kann Essigsäure abgespalten werden. Diese Reaktion heißt 17-α-Hydroxyprogesteron-Aldolase (kurz: 17,20-Lyase) und findet am gleichen Zentrum wie die Hydroxylierung statt. Wie bei der Hydroxylierung kann auch das Pregnenolonderivat als Substrat herhalten:[3][4]
Einzelnachweise
- ↑ Homologe bei inParanoid
- ↑ UniProt P05093
- ↑ Bernhard Kleine: Hormone und Hormonsystem. 2. Auflage. Springer, Berlin 2010, ISBN 978-3-642-00901-3.
- ↑ Bhangoo A, Aisenberg J, Chartoffe A, et al.: Novel mutation in cytochrome P450c17 causes complete combined 17alpha-hydroxylase/17,20-lyase deficiency. In: J. Pediatr. Endocrinol. Metab. 21. Jahrgang, Nr. 2, Februar 2008, S. 185–90, PMID 18422032.
Weblinks
- Jassal / reactome: Hydroxylation of pregnenolone to form 17alpha-hydroxypregnenolone
- Jassal / reactome: Side chain cleavage of 17alpha-hydroxyprenenolone to yield DHA
- Jassal / reactome: Hydroxylation of progesterone to form 17alpha-hydroxyprogesterone
- Jassal / reactome: Side chain cleavage of 17alpha-hydroxyprogesterone to yield 4-androstene-3,17-dione



