Kalomelelektrode
Die Kalomelelektrode (GKE, engl.: Saturated Calomel Electrode, SCE) ist eine Elektrode zweiter Art.
Aufbau[Bearbeiten | Quelltext bearbeiten]
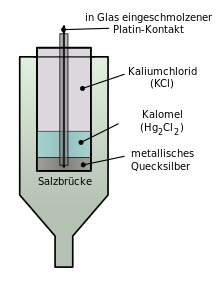
Eine Kalomelelektrode besteht aus Quecksilber, welches mit schwerlöslichem Kalomel (Hg2Cl2) überzogen ist und in eine gesättigte Kaliumchlorid-Lösung taucht. Mit der Analysenlösung kann Kontakt über ein Diaphragma (semipermeable Membran) oder einen Flüssigkeitsfilm im Schliffstopfen hergestellt werden.
Die Zellnotation der gesättigten Kalomelelektrode lautet:
Funktionsprinzip[Bearbeiten | Quelltext bearbeiten]
Die potentialbestimmende Elektrodenreaktion ist das Gleichgewicht zwischen Metall in der Elektrode und Metallionen in der KCl-Lösung:
Das Potential der Elektrode, E, wird durch die Nernst-Gleichung beschrieben, wobei E° das Standardpotential der Elektrodenreaktion, R die allgemeine Gaskonstante, T die thermodynamische Temperatur und F die Faraday-Konstante ist:
Für das Löslichkeitsgleichgewicht gilt:
Das Löslichkeitsprodukt, KL, ist damit folglich:
Die Gleichung des Löslichkeitsprodukts kann für die Quecksilberkonzentration eingesetzt werden, um das Potential allein in Abhängigkeit von der Chloridkonzentration zu erhalten:
Der KL-Term ist wie das Standardpotential lediglich von der Temperatur abhängig. Es ist also sinnvoll, ihn in ein neu definiertes Standardpotential, das der Kalomelelektrode, einzubeziehen:
Literatur[Bearbeiten | Quelltext bearbeiten]
- Matthias Otto: Analytische Chemie. 3., vollständig überarbeitete und erweiterte Auflage. Wiley-VCH, Weinheim 2006, ISBN 3-527-31416-4, S. 366.


![{\displaystyle E=E^{\circ }(\mathrm {Hg} /\mathrm {Hg} _{2}^{2+})+{\frac {RT}{2F}}\ln[\mathrm {Hg} _{2}^{2+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cd9be71a0cb4e6dcd0e4e9d6dec7d7e330022f4)

![{\displaystyle K_{L}=[\mathrm {Hg_{2}^{2+}} ]\ [\mathrm {Cl} ^{-}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c982c5bd9fae230d14230a8efa733d430620543c)
![{\displaystyle E=E^{\circ }(\mathrm {Hg} /\mathrm {Hg} _{2}^{2+})+{\frac {RT}{2F}}\ln {\frac {K_{L}}{[\mathrm {Cl} ^{-}]^{2}}}=E^{\circ }(\mathrm {Hg} /\mathrm {Hg} _{2}^{2+})+{\frac {RT}{2F}}(\ln(K_{L})-2\ln {[\mathrm {Cl} ^{-}])}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b656ea143dd0fd21487729b6efb53496a9da9505)
![{\displaystyle E=E^{\circ }(\mathrm {Hg} /\mathrm {Hg} _{2}^{2+}/\mathrm {Cl} ^{-})-{\frac {RT}{F}}\ln[\mathrm {Cl} ^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/177948c377485d6dab1709383fc662414a90c28e)