Reagenz nach Busch
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Reagenz nach Busch | |||||||||
| Andere Namen |
| |||||||||
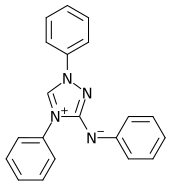
| Summenformel | C20H16N4 | |||||||||
| Kurzbeschreibung |
licht und luftempfindliches gelblichgrünes Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 312,37 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
fast unlöslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
„Reagenz nach Busch“ ist der Trivialname einer chemischen Verbindung aus der Gruppe der Triazole, die nach ihrem Entdecker, dem Chemiker Max Busch, benannt wurde.[3] Ebenfalls geläufig ist die Bezeichnung Nitron, obwohl das Reagenz nicht zur Stoffgruppe der Nitrone zählt und sich von diesen strukturell erheblich unterscheidet.

Nitron (3-Anilino-1,4-diphenyl-1,2,4-triazolium, C20H16N4) liegt als gelbliches Pulver vor, bildet ein Zwitterion („Mesoion“ bzw. „Mesomeres Betain“) und ist löslich in Alkohol, Benzol und verdünnter Essigsäure unter Bildung des Acetats von Nitron. Dieses wird zum Nachweis von Nitrat-Ionen verwendet, wobei sich das Nitrat des Nitrons (C20H16N4 · HNO3) bildet, das praktisch unlöslich ist.
Zum Nachweis von Nitraten gibt man zu der mit verdünnter Schwefelsäure angesäuerten Probelösung unter Erwärmen Nitronacetatlösung, wobei sich ein weißlicher Niederschlag bildet. Dieses Verfahren wurde auch zum quantitativen Nachweis von Nitraten angewendet, wobei der Niederschlag nach dem Abfiltrieren und Trocknen gewogen wird (gravimetrisches Verfahren). Störend wirken dabei allerdings Bromid-, Iodid-, Perchlorat- und Nitrit-Ionen, die mit Nitron ebenfalls schwer lösliche Niederschläge bilden.
Literatur
- Eintrag zu Nitron. In: Römpp Online. Georg Thieme Verlag
- Gerhard-Otfried Müller: Praktikum der quantitativen chemischen Analyse, S. Hirzel Verlag Leipzig, 8. Auflage 1966, S. 353.