Benutzer:MaFecht93/Spielwiese/Chemie/Mukaiyama-Aldolreaktion
| Edukte |
|---|
 Aldehyd (R1 = Alkyl, Aryl) oder Ameisensäureester (R1 = OR) |
 Silyliertes Enol (R1 = Alkyl, Aryl, H; R2 = Alkyl, Aryl, H, OR, SR) |
Die Mukaiyama-Aldolreaktion, auch Mukaiyama-Reaktion genannt, ist eine Namensreaktion der organischen Chemie und wurde in den frühen 1970er Jahren durch den japanischen Chemiker Teruaki Mukaiyama (* 1927) entdeckt.[1][2]
Es handelt es sich um eine Form der gekreuzten Aldolreaktion und zählt zu den wichtigsten Reaktionen zur Bildung von Kohlenstoff-Kohlenstoff-Bindungen.[3]
Die Mukaiyama-Aldolreaktion ist verwandt mit der Mukaiyama-Michael-Reaktion.
Übersicht
[Bearbeiten | Quelltext bearbeiten]Bei der Mukaiyama-Aldolreaktion werden Enol-Silane unter Anwesenheit einer Lewis-Säure an Carbonylverbindungen addiert. Die Reaktion lässt eine Vielzahl möglicher Reste zu (siehe Edukte).[3] Im einfachsten Fall (R2 = H) und ohne den Einsatz von chiralen Katalysatoren läuft die Reaktion wie folgt ab:

Es bildet sich bei der Reaktion ein Gemisch aus zwei Reaktionsprodukten, genauer ein Racemat. Werden Gemische aus cis- und trans-Isomeren der jeweiligen silierten Enole verwendet, entstehen vier Reaktionsprodukte:

Sowohl das syn-Diastereomer als auch anti-Diastereomer treten als Racemat auf. Ob sich bei der Reaktion bevorzugt das anti-Diastereomer oder das syn-Diastereomer bildet, hängt von den eingesetzten Edukten, Reagenzien sowie den vorherrschenden Reaktionsbedinungen ab.
In der Originalaufarbeit wurden stöchiometrische Mengen von Lewis-Säuren, wie beispielsweise TiCl4, SnCl4 oder Ähnliche, verwendet.[2] In späteren Studien wurden jedoch verschiedene katalytische Versionen entwickelt. Dabei konnten sowohl verschiedene Lewis-Säuren als auch Lewis-Basen zur Durchführung der Reaktion verwendet werden.[1]
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Ein möglicher Mechanismus wird von László Kürti und Barbara Czakó in dem Buch: Strategic Applications of Named Reactions in Organic Synthesis formuliert.[3] In dem vorliegenden Beispiel zum Reaktionsmechanismus wird die Lewis-Säure TiCl4 als Katalysator verwendet:

Im ersten Reaktionsschritt wird die Carbonylgruppe des Aldehyds durch die zugesetzte Lewis-Säure aktiviert. Anschließend greift die Doppelbindung des Silans an der aktivierten Carbonylgruppe an bildet eine neue Kohlenstoff-Kohlenstoff-Bindung aus. Unter Abspaltung eines Silylchlorids bildet sich der Komplex 1. Durch Aufarbeitung, sprich Hydrolyse, erhält man ein racemisches Gemisch der Aldole 2 und 3.[3]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Der Reaktion kommt eine große Bedeutung in der moderen Synthesechemie zu. Durch den Einsatz chiraler Lewis-Säuren als Katalysator kann die Stereochemie besonders effektiv beeinflusst werden.[4] Unter Verwendung eines chiralen Katalysators, hier als L* gekennzeichnet, verläuft die Reaktion nach folgendem Reaktionsschema:

Eine der zahlreichen Anwendungen der Mukaiyama-Aldolreaktion findet sich beispielsweise in der Synthese des Naturstoffs Sphingofungin B.[3] Folgendes Reaktionsschema zeigt die Synthese eines wichtigen Zwischenprodukts in der Sphingofungin-B-Synthese:
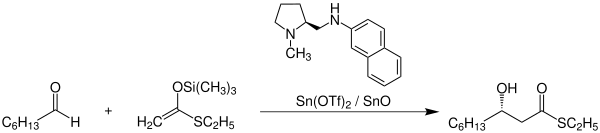
Die Mukaiyama-Aldolreaktion wird hier vor allem aufgrund der exzellenten Stereoselektivität genutzt.[4] Unter Verwendung eines (S)-Prolin-Derivats als chiraler Ligand am Katalysator kann mit einer Ausbeute von 87% und einem Enantiomerenüberschuss von 94% das abgebildete Produkt synthetisiert werden. Hierbei steht die verwendete Abkürzung Tf für Triflat.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey '''2009''', ISBN 978-0-471-70450-8, S. 1991–1995.
- ↑ a b Mukaiyama, T., Narasaka, K., Banno, K. New aldol type reaction. Chem. Lett. 1973, 1011–1014
- ↑ a b c d e László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 298–299, ISBN 978-0-12-429785-2.
- ↑ a b Thomas Laue und Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie, Teuber Verlag, Wiesbaden, 2006, Seite 11, ISBN 3-8351-0091-2.