Steglich-Veresterung
Bei der Steglich-Veresterung handelt es sich um eine Namensreaktion in der Organischen Chemie. Sie ist eine Veresterungsmethode und wurde erstmals 1978 von Wolfgang Steglich (* 1933) beschrieben.[1] Mit diesem Verfahren können sterisch anspruchsvolle Alkohole mit Carbonsäuren verestert werden.
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Unter dem Einfluss von Dicyclohexylcarbodiimid (DCC) und 4-Dimethylaminopyridin (DMAP) werden sekundäre und tertiäre Alkohole verestert. Dabei sind R1, R2, R3 Alkyl- oder Arylreste und R4 ist ein Alkyl-, Arylrest oder Wasserstoffatom.
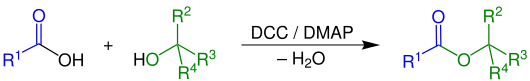
Mechanismus
[Bearbeiten | Quelltext bearbeiten]
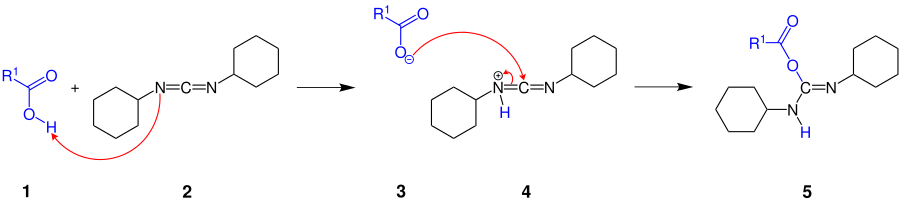
Die Steglich-Veresterung stellt eine Anpassung der schon länger zur Bildung von Carbonsäureamiden bekannten Methode mittels DCC und 1-Hydroxybenzotriazol (HOBT) dar.[2][3] Bei der Darstellung von Carbonsäureestern mit der DCC-Methode können jedoch unerwünschte Nebenreaktionen stattfinden. Durch eine [1,3]-Umlagerung am O-Acylisoharnstoff reagiert dieser irreversibel zum N-Acylisoharnstoff. Diese Acylwanderung verhindern Acetylgruppen-Überträger, wie DMAP. Durch den sogenannten Steglich-Katalysator[4] DMAP wird die DCC-aktivierte Veresterung so beschleunigt, dass die Bildung von Nebenprodukten ausbleibt und sterisch anspruchsvolle Ester bei Raumtemperatur in guten Ausbeuten entstehen.[1]
Der Übersicht halber wird der folgende Reaktionsmechanismus mit einem primären Alkohol dargestellt.[4]
Die Carboxygruppe der Carbonsäure 1 addiert an eine C=N-Doppelbindung des DCC (N,N′-Dicyclohexylcarbodiimid) (2), wobei der O-Acylisoharnstoff 5 gebildet wird. Dabei wird als Zwischenschritt durch Protonierung des DCCs das Carboxylat-Anion 3 und die Verbindung 4 gebildet. Der Einsatz von DCC beschleunigt die Reaktion, da die Reaktivität des O-Acylisoharnstoff höher ist als die der Carbonsäure.
Um die Ausbeute zu steigern wird DMAP (4-Dimethylaminopyridin) (6) eingesetzt. DMAP ist nucleophiler als der Alkohol und reagiert mit dem O-Acylisoharnstoff 5 zu einem reaktiven N-Acylpyridiniumion 7:
Der Alkohol reagiert nun mit der reaktiven Zwischenstufe, dem N-Acylpyridiniumion 7. In einer Gleichgewichtsreaktion findet eine Protonen-Übertragung statt:
Im letzten Schritt greift der deprotonierte N,N′-Dicyclohexylharnstoff das Proton der Verbindung 8 an, wobei sich der entsprechende Ester 9 bildet und 6 abgespalten wird. Das bei einer Veresterung freigesetzte Wasser nimmt das DCC auf unter Bildung von N,N′-Dicyclohexylharnstoff (DCU):
(DCU, „U“ steht für die lat. Bezeichnung „Urea“ für Harnstoff)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b B. Neises, W. Steglich: Einfaches Verfahren zur Veresterung von Carbonsäuren. In: Angewandte Chemie. Band 90, 1978, S. 556–557.
- ↑ J. C. Sheehan, G. P. Hess: A New Method of Forming Peptide Bonds. In: J. Am. Chem. Soc. 77, 1955, S. 1067–1068.
- ↑ W. König, R. Geiger: Eine neue Methode zur Synthese von Peptiden: Aktivierung der Carboxygruppe mit Dicyclohexylcarbodiimid unter Zusatz von 1-Hydroxy-benzotriazolen. In: Chemische Berichte. 103, 1970, S. 788–798.
- ↑ a b Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Set aus 3 Bänden. John Wiley & Sons, Hoboken, N.J 2009, ISBN 978-0-471-70450-8, S. 2651–2655.
Literatur
[Bearbeiten | Quelltext bearbeiten]- J. Otera: Esterification. 1. Auflage. Wiley-VCH, Weinheim 2003, ISBN 3-527-30490-8.