Strychnos-Alkaloide


Strychnos-Alkaloide sind Naturstoffe, die vor allem in den Samen der Gewöhnlichen Brechnuss (Strychnos nux-vomica) und in den Catharanthen (Catharanthus) vorkommen.[1]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Die Samen der Gewöhnlichen Brechnuss, enthalten bis zu 2,5 % Strychnin und Brucin.[2]
Vertreter[Bearbeiten | Quelltext bearbeiten]
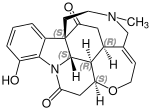
Hauptvertreter dieser Gruppe von Alkaloiden ist das Strychnin. Ein weiteres Alkaloid ist das Brucin.[1][3] Weitere Vertreter sind das Vomicin und das Akuammicin.[4]
-
Strychnin
-
Brucin
-
Vomicin
-
Akuammicin
Stereochemie[Bearbeiten | Quelltext bearbeiten]
Die in der Natur vorkommenden Strychnos-Alkaloide sind alle chiral und sterisch einheitlich. Wenn in diesem Artikel oder in der wissenschaftlichen Literatur eines dieser Alkaloide ohne weiteren Namenszusatz benannt wird, steht eigentlich:
- Akuammicin für (–)-Akuammicin,
- Brucin für (–)-Brucin,
- Strychnin für (–)-Strychnin und
- Vomicin für (+)-Vomicin.
Die Klammerausdrücke stehen für den Drehsinn der optischen Aktivität dieser Substanzen.
Verwendung und pharmakologische Wirkung[Bearbeiten | Quelltext bearbeiten]
Strychnin ist sehr giftig. In geringer Dosis wirkt es anregend bis euphorisierend. Eine höhere Dosis führt zur krampfartigen Zuständen.[4] 100 bis 130 mg gelten für einen erwachsenen Menschen als tödlich.[3]
Das Brucin ähnelt dem Strychnin in seiner Struktur und seiner physiologischen Wirkung. Es gilt als weniger giftig. Beide Alkaloide finden Verwendung als Rattengift und als optisch aktive Basen bei der Enantiomerentrennung racemischer Säuren.[5]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Bereits 1818 wurde Strychnin von Pierre Joseph Pelletier und Joseph Bienaimé Caventou aus der Ignatiusbohne (Strychnos ignatii) extraktiv gewonnen.[6] Mit der Strukturaufklärung des Strychnins beschäftigten sich vor allem Hermann Leuchs, Robert Robinson und Heinrich Wieland. Endgültig wurde die Struktur durch die Totalsynthese (Robert B. Woodward, 1954) gesichert.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Peter Nuhn: Naturstoffchemie. 4. Auflage. S.Hirzel Verlag, Stuttgart 2006, ISBN 978-3-7776-1363-5, S. 613.
- ↑ Oliver Kayser, N. Averesch: Technische Biochemie. Springer Fachmedien, Wiesbaden 2015, ISBN 978-3-658-05548-6, S. 613 f.
- ↑ a b Gerhard G. Habermehl, P. Hammann, H. Krebs: Naturstoffchemie. 2. Auflage. Springer-Verlag, Berlin/Heidelberg 2002, ISBN 978-3-540-43952-3, S. 191.
- ↑ a b Eberhard Breitmaier: Alkaloide. Springer Fachmedien, Wiesbaden 1997, ISBN 978-3-519-03542-8, S. 50.
- ↑ Adalbert Wollrab: Organische Chemie. 4. Auflage. Springer-Verlag, Berlin 2014, ISBN 978-3-642-45144-7, S. 1048.
- ↑ Winfried R. Pötsch, Annelore Fischer und Wolfgang Müller unter Mitarbeit von Heinz Cassebaum: Lexikon bedeutender Chemiker, VEB Bibliographisches Institut Leipzig, 1988, ISBN 3-323-00185-0, S. 81–82.