Zirconium(IV)-borhydrid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
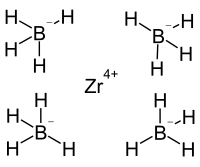
| |||||||
| Allgemeines | |||||||
| Name | Zirconium(IV)-borhydrid | ||||||
| Andere Namen |
| ||||||
| Summenformel | Zr(BH4)4 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 150,59 g·mol−1 | ||||||
| Aggregatzustand |
fest bis flüssig | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
123 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Zirconium(IV)-borhydrid ist eine chemische Verbindung aus der Gruppe der Zirconiumverbindungen und Borane.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese erfolgt durch die Umsetzung von Lithiumborhydrid mit Zirconium(IV)-chlorid.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Zirconium(IV)-borhydrid ist ein niedrig schmelzender Feststoff und oberhalb des Schmelzpunktes eine leicht flüchtige Flüssigkeit.[1] Der niedrige Schmelzpunkt bei 28,7 °C und der niedrige Siedepunkt bei 123 °C weisen auf eine Komplexverbindung statt einer ionischen Salzverbindung hin. Die Bestimmung der Kristallstruktur ergab eine hochkoordinierte Struktur, wobei jeweils drei der Wasserstoffatome der Boronateinheiten mit dem Zentralion koordiniert sind.[4] Die thermische Zersetzung der Verbindung oberhalb von 250 °C gibt ein Produkt mit der Zusammensetzung ZrB2,76–3,74, wobei die kristalline Phase aus Zirconiumdiborid und der Rest aus amorphen Bor besteht.[5] In der Gasphase erfolgt die Zersetzung nach:[6]
Die Verbindung ist pyrophor, sie entzündet sich in Gegenwart von Luft selbst, wobei die Entzündung verzögert unter Explosion verlaufen kann.[1] In Gegenwart von Wasser erfolgt eine schnelle Hydrolyse.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Verbindung dient als Ausgangsstoff für die Gewinnung von Zirkoniumdiborid ZrB2, welches für Hochtemperaturkeramiken[3] oder zur Beschichtung von Glas- oder Metalloberflächen[6] eingesetzt werden kann. In der organischen Chemie wird es als effektives Reduktionsmittel eingesetzt.[7][1] Des Weiteren wurde die Verbindung als Wasserstoffspeichermaterial vorgeschlagen.[8]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Roth/Weller: Gefährliche Chemische Reaktionen, ecomed SICHERHEIT, Verlagsgruppe Hüthig Jehle Rehm, Ausgabe 08/2011.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Rice, G.W.; Woodin, R.L.: Zirconium Borohydride as a Zirconium Boride Precursor in J. Am. Ceramic Soc. 71 (1988) c181–c183, doi:10.1111/j.1151-2916.1988.tb05867.x.
- ↑ Bird, P.H.; Churchill, M.R.: The crystal structure of zirconium(IV) borohydride (at –160°) in Chem. Commun. (London), 1967, 403, doi:10.1039/C19670000403.
- ↑ Andrievskii, R. A.; Kravchenko, S. E.; Shilkin, S. P.: Preparation and some properties of ultrafine zirconium boride and titanium boride powders in Inorganic Materials (Translation of Neorganicheskie Materialy) 31 (1995) 965–968.
- ↑ a b Jensen, J A.; Gozum, J.E.; Pollina, D.M.; Girolami, G.S.: Titanium, zirconium, and hafnium tetrahydroborates as "tailored" CVD precursors for metal diboride thin films in J. Am. Chem. Soc. 110 (1988) 1643–1644, doi:10.1021/ja00213a058.
- ↑ Narasimhan, S.; Balakumar, R.: Zirconium Borohydride - a Versatile Reducing Agent for the Reduction of Electrophilic and Nucleophilic Substrates in Synth. Comm. 30 (2000) 4387–4395, doi:10.1080/00397910008087061.
- ↑ Soloveichik, G.L.: Metal Borohydrides as Hydrogen Storage Materials in Material Matters 2007, 2.2, 11.

