„Bariumoxalat“ – Versionsunterschied
Rjh (Diskussion | Beiträge) AZ: Die Seite wurde neu angelegt: {{Infobox Chemikalie | Strukturformel = Datei:Barium oxalate.png|250px|Strukturformel von Bariumox… |
(kein Unterschied)
|
Version vom 4. November 2015, 22:01 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
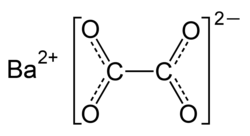
| ||||||||||
| Allgemeines | ||||||||||
| Name | Bariumoxalat | |||||||||
| Summenformel | BaC2O4 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 225,35 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
2,658 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Bariumoxalat ist eine chemische Verbindung des Bariums aus der Gruppe der Oxalate.
Gewinnung und Darstellung
Bariumoxalat kann durch Reaktion von Bariumchlorid mit Oxalsäurelösung oder Ammoniumoxalat gewonnen werden.[4]
Eigenschaften
Bariumoxalat und sein Monohydrat sind weiße, geruchlose Feststoffe, die praktisch unlöslich in Wasser sind.[1][2] Das Monohydrat wandelt sich bei 140 bis 150 °C in das Anhydrat um.[3]
Das Dihydrat hat eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[5] Das Monohydrat und das 3,5-Hydrat haben eine monokline Kristallstruktur mit der Raumgruppe C2/m (Nr. 12) bzw. C2/c (Nr. 15).[6][7] Das Hemihydrat und das a-Anhydrat haben eine trikline Kristallstruktur mit der Raumgruppe P1 (Nr. 2).[8]
Verwendung
Bariumoxalat-monohydrat wird in Pyrotechnik und als Analysereagenz verwendet.[9]
Einzelnachweise
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g Datenblatt Bariumoxalat bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ a b P. H. List, L. Hörhammer: Chemikalien und Drogen (Am – Ch). Springer-Verlag, 2013, ISBN 978-3-642-80562-2, S. 365 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wilhelm Hurka: Chemisches Praktikum für Mediziner. Springer-Verlag, 2013, ISBN 978-3-662-02242-9, S. 32 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Nørl und Christensen, R.G. Hazell, A.M.T. Bell, A. Altomare: Precision of a crystal structure derived from a synchrotron X-ray powder pattern. The structure of Barium oxalate hydrate, BaC2O4-2H2O. In: Journal of Physics and Chemistry of Solids. 56, 1995, S. 1359, doi:10.1016/0022-3697(95)00070-4.
- ↑ R. Neder, M. Burghammer, H. Schulz, A. N. Christensen, H. G. Krane, A. M. T. Bell, A. W. Hewat, A. Altomare: Crystal structure determination of barium Oxalate, BaC2O4 - 3.5 H2O/D2O. In: Zeitschrift für Kristallographie - Crystalline Materials. 212, 1997, doi:10.1524/zkri.1997.212.4.305.
- ↑ Huang Sheng-hua, Thomas C. W. Mak: Refinement of the crystal structure of barium Oxalate monohydrate. In: Zeitschrift für Kristallographie - Crystalline Materials. 190, 1990, doi:10.1524/zkri.1990.190.3-4.305.
- ↑ Axel Nørlund Christensen, Rita Grønbæk Hazell, Ian Charles Madsen: Synthesis and characterization of the barium oxalates BaC2O4-0.5H2O, α-BaC2O4 and β-BaC2O4. In: Acta Crystallographica Section B Structural Science. 58, 2002, S. 808, doi:10.1107/S0108768101020717.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).


