„Acetolactat-Synthase“ – Versionsunterschied
Zur Navigation springen
Zur Suche springen
| [ungesichtete Version] | [ungesichtete Version] |
Inhalt gelöscht Inhalt hinzugefügt
K Symbol |
→Einleitung: Text... |
||
| Zeile 36: | Zeile 36: | ||
| Orthologe = |
| Orthologe = |
||
}} |
}} |
||
Die '''Acetolactat-Synthase''' ist ein [[Enzym]], das an der Bildung der [[Aminosäuren]] Valin und Leucin beteiligt ist.<ref>{{Literatur|Autor=Hans Walter Heldt, Birgit Piechulla|Titel=Pflanzenbiochemie|Verlag=Springer|Ort=Berlin, Heidelberg|Jahr=2015|Kapitel=|Seiten=281|ISBN=978-3-662-44397-2|DOI=10.1007/978-3-662-44398-9_1}}</ref> |
Die '''Acetolactat-Synthase''' ist ein [[Enzym]], das bei sehr vielen Pro- und Eukaryoten an der Bildung der [[Aminosäuren]] Valin und Leucin beteiligt ist.<ref>{{Literatur|Autor=Hans Walter Heldt, Birgit Piechulla|Titel=Pflanzenbiochemie|Verlag=Springer|Ort=Berlin, Heidelberg|Jahr=2015|Kapitel=|Seiten=281|ISBN=978-3-662-44397-2|DOI=10.1007/978-3-662-44398-9_1}}</ref> Da für Menschen beide essenzielle Aminosäuren sind, kommt das Enzym vor allem bei Pflanzen, Hefen und einigen Arthropoden vor. |
||
<!-- |
|||
*Lit1 |
|||
*Lit2<ref>{{Literatur|Autor=A. Joutel, A. Ducros, S. Alamowitch, C. Cruaud, V. Domenga, E. Maréchal, K. Vahedi, H. Chabriat, M. G. Bousser, E. Tournier-Lasserve|Titel=A human homolog of bacterial acetolactate synthase genes maps within the CADASIL critical region|Sammelwerk=Genomics|Band=38|Nummer=2|Verlag=|Jahr=1996|Monat=12|Tag=01|Seiten=192–198|ISSN=0888-7543|DOI=10.1006/geno.1996.0615|PMID=8954801}}</ref> |
|||
*Lit3<ref>{{Literatur|Autor=D. Chipman, Z. Barak, J. V. Schloss|Titel=Biosynthesis of 2-aceto-2-hydroxy acids: acetolactate synthases and acetohydroxyacid synthases|Sammelwerk=Biochimica Et Biophysica Acta|Band=1385|Nummer=2|Verlag=|Jahr=1998|Monat=06|Tag=29|Seiten=401–419|ISSN=0006-3002|PMID=9655946}}</ref> |
|||
*Lit4<ref>{{Literatur|Autor=Jennifer A. McCourt, Siew Siew Pang, Jack King-Scott, Luke W. Guddat, Ronald G. Duggleby|Titel=Herbicide-binding sites revealed in the structure of plant acetohydroxyacid synthase|Sammelwerk=Proceedings of the National Academy of Sciences of the United States of America|Band=103|Nummer=3|Verlag=|Jahr=2006|Monat=01|Tag=17|Seiten=569–573|ISSN=0027-8424|DOI=10.1073/pnas.0508701103|PMID=16407096}}</ref> |
|||
*Lit5<ref>{{Literatur|Autor=F. E. Dailey, J. E. Cronan|Titel=Acetohydroxy acid synthase I, a required enzyme for isoleucine and valine biosynthesis in Escherichia coli K-12 during growth on acetate as the sole carbon source|Sammelwerk=Journal of Bacteriology|Band=165|Nummer=2|Verlag=|Jahr=1986|Monat=02|Tag=01|Seiten=453–460|ISSN=0021-9193|PMID=3511034}}</ref> |
|||
*Lit6<ref>{{Literatur|Autor=Daryl L. Richie, Katherine V. Thompson, Christian Studer, Vivian C. Prindle, Thomas Aust, Ralph Riedl, David Estoppey, Jianshi Tao, Jessica A. Sexton, Thomas Zabawa, Joseph Drumm, Simona Cotesta, Jürg Eichenberger, Sven Schuierer, Nicole Hartmann, N. Rao Movva, John A. Tallarico, Neil S. Ryder, Dominic Hoepfner|Titel=Identification and Evaluation of Novel Acetolactate Synthase Inhibitors as Antifungal Agents|Sammelwerk=Antimicrobial Agents and Chemotherapy|Band=57|Nummer=5|Verlag=|Jahr=2013|Monat=05|Tag=01|Seiten=2272–2280|ISSN=0066-4804, 1098-6596|Online=[http://aac.asm.org/content/57/5/2272 asm.org]|DOI=10.1128/AAC.01809-12}}</ref> |
|||
--> |
|||
== Aufbau == |
|||
<ref>{{Literatur|Autor=Siew Siew Pang, Ronald G. Duggleby, Richard L. Schowen, Luke W. Guddat|Titel=The Crystal Structures of Klebsiella pneumoniae Acetolactate Synthase with Enzyme-bound Cofactor and with an Unusual Intermediate|Sammelwerk=Journal of Biological Chemistry|Band=279|Nummer=3|Verlag=|Jahr=2004|Monat=01|Tag=16|Seiten=2242–2253|ISSN=0021-9258, 1083-351X|Online=[http://www.jbc.org/content/279/3/2242 jbc.org]|DOI=10.1074/jbc.M304038200}}</ref> |
Das Enzym ist aus zwei Untereinheiten aufgebaut <!--WIE?--> und enthält als [[prosthetische Gruppe]] [[Thiaminpyrophosphat]].<ref>{{Literatur|Autor=Siew Siew Pang, Ronald G. Duggleby, Richard L. Schowen, Luke W. Guddat|Titel=The Crystal Structures of Klebsiella pneumoniae Acetolactate Synthase with Enzyme-bound Cofactor and with an Unusual Intermediate|Sammelwerk=Journal of Biological Chemistry|Band=279|Nummer=3|Verlag=|Jahr=2004|Monat=01|Tag=16|Seiten=2242–2253|ISSN=0021-9258, 1083-351X|Online=[http://www.jbc.org/content/279/3/2242 jbc.org]|DOI=10.1074/jbc.M304038200}}</ref> |
||
== Funktion == |
|||
Die Acetolactat-Synthase katalysiert den ersten Schritt der [[AS-Synthese|Synthese]], indem sie aus zwei Molekülen [[Pyruvat]] CO<sub>2</sub> abspaltet. Dabei wird [[2-Hydroxy-2-methyl-3-oxobuttersäure|α-Acetolactat]] gebildet, welches die Grundlage für den weiteren Syntheseweg bildet. Die Acetolactat-Synthase ist ein Angriffspunkt für einige [[Herbizide]] wie [[Chlorsulphuron]].<ref>{{Literatur|Autor=Peter Schopfer, Axel Brennicke, Hans Mohr|Titel=Pflanzenphysiologie|Auflage=7.|Verlag=Spektrum, Akad. Verl|Ort=Heidelberg|Jahr=2010|ISBN=978-3-8274-2351-1}}</ref> |
|||
<!-- REAKTIONSGLEICHUNG --> |
|||
== Eigenschaften == |
== Eigenschaften == |
||
Version vom 2. Februar 2016, 22:31 Uhr
Diese Baustelle befindet sich fälschlicherweise im Artikelnamensraum. Bitte verschiebe die Seite oder entferne den Baustein {{Baustelle}}.
|
| Acetolactat-Synthase | ||
|---|---|---|
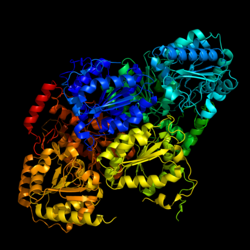
| ||
| nach PDB 1n0h | ||
| Masse/Länge Primärstruktur | 677 Aminosäuren | |
| Kofaktor | Thiamindiphosphat, Mg2+ | |
| Bezeichner | ||
| Gen-Name(n) | ILV2 | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 2.2.1.6, Transketolase | |
| Reaktionsart | Decarboxylierung | |
| Substrat | Pyruvat | |
| Produkte | α-Acetolactat | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Die Acetolactat-Synthase ist ein Enzym, das bei sehr vielen Pro- und Eukaryoten an der Bildung der Aminosäuren Valin und Leucin beteiligt ist.[1] Da für Menschen beide essenzielle Aminosäuren sind, kommt das Enzym vor allem bei Pflanzen, Hefen und einigen Arthropoden vor.
Aufbau
Das Enzym ist aus zwei Untereinheiten aufgebaut und enthält als prosthetische Gruppe Thiaminpyrophosphat.[2]
Funktion
Die Acetolactat-Synthase katalysiert den ersten Schritt der Synthese, indem sie aus zwei Molekülen Pyruvat CO2 abspaltet. Dabei wird α-Acetolactat gebildet, welches die Grundlage für den weiteren Syntheseweg bildet. Die Acetolactat-Synthase ist ein Angriffspunkt für einige Herbizide wie Chlorsulphuron.[3]
Eigenschaften
Einzelnachweise
- ↑ Hans Walter Heldt, Birgit Piechulla: Pflanzenbiochemie. Springer, Berlin, Heidelberg 2015, ISBN 978-3-662-44397-2, S. 281, doi:10.1007/978-3-662-44398-9_1.
- ↑ Siew Siew Pang, Ronald G. Duggleby, Richard L. Schowen, Luke W. Guddat: The Crystal Structures of Klebsiella pneumoniae Acetolactate Synthase with Enzyme-bound Cofactor and with an Unusual Intermediate. In: Journal of Biological Chemistry. Band 279, Nr. 3, 16. Januar 2004, ISSN 0021-9258, 1083-351X(?!), S. 2242–2253, doi:10.1074/jbc.M304038200 (jbc.org).
- ↑ Peter Schopfer, Axel Brennicke, Hans Mohr: Pflanzenphysiologie. 7. Auflage. Spektrum, Akad. Verl, Heidelberg 2010, ISBN 978-3-8274-2351-1.